| Be
notified of page updates |
| powered by ChangeDetection |
Comparée à la durée de vie des moustiques,
celle des tiques est remarquable, avec un cycle de développement s'étendant
souvent sur plusieurs années en raison d'une capacité à
survivre longtemps dans l'attente de se gorger (Sonenshine, 1991). Différentes
publications montrent que, de leur côté, les virus parviennent
à se maintenir toute la vie durant des tiques (Rehacek, 1965; Davies,
Jones & Nuttall, 1986). Les stratégies de survie des tiques profitent
aux virus qu'ils transmettent, leur longévité exceptionnelle
permet aux virus de se maintenir pendant des années. De fait les tiques
sont à la fois de bons vecteurs et d'excellents réservoirs (Blaskovic
& Nosek, 1972)...
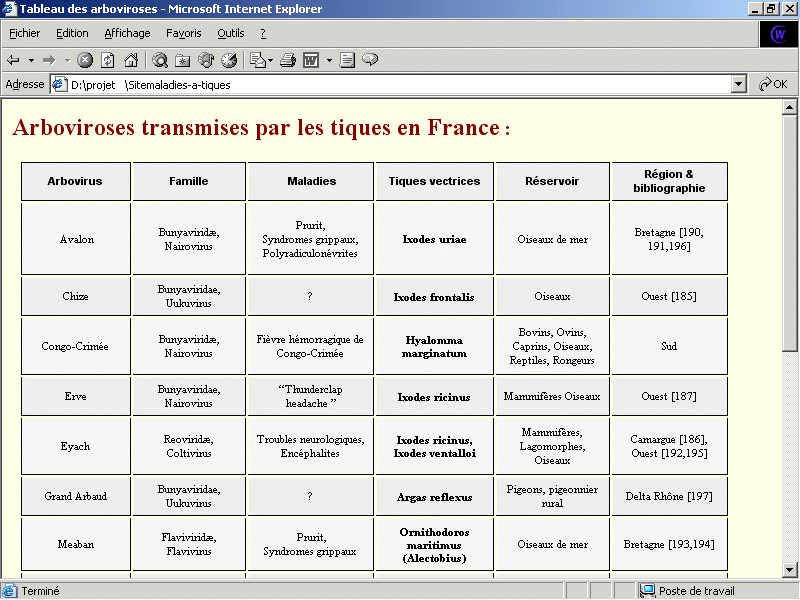
À ce jour, plus de dix arboviroses transmises par la morsure de tiques ont été identifiées en France. L’encéphalite européenne, propagée par Ixodes ricinus, est sans aucun doute la plus connue, et la plus importante en terme de Santé Publique. Cette même espèce de tique peut aussi propager le virus Erve alors que ce sont plus probablement les Dermacentor sp. qui transmettent le virus Eyach. Ces deux virus ont été reconnus responsables de pathologies graves au début des années 80 [118].
Les autres arboviroses sont détectées dans les zones où séjournent les oiseaux. Elles sont le plus souvent transmises par la morsure de tiques ornithophiles, et occasionnellement anthropophiles. La pullulation des goélands argentés et des pigeons en ville, étend maintenant le risque de contamination aux animaux domestiques et à l'homme.
Les voyageurs, de retour de pays plus ou moins lointains,
peuvent également avoir être victimes d'arbovirus mal connus
en Europe, qu'il est cependant nécessaire d'identifier. Ces virus exotiques
seront donc évoqués à la fin de cette page.
On remarquera à cette occasion que la distinction entre "Arbovirus
transmis par les tiques" et "Arbovirus transmis par les moustiques"
n'est pas aussi stricte que supposée naguère. Il existe souvent
des cycles secondaires impliquant réellement à la fois tiques
et moustiques dans l'écologie des arbovirus.
C'est notamment le cas pour West Nile, Omsk, Powassan...
L'étude Encéphalite
2007 (InVS & Spilf) devrait faire progresser la connaissance des arboviroses
en France, même si l'on peut déplorer qu'Erve ou Eyach notamment,
ne figurent toujours pas dans la recherche du diagnostic étiologique.
L’encéphalite européenne à tiques,
ou méningo-encéphalite verno-estivale, est une zoonose due à
un Flavivirus appartenant au complexe antigénique Tick-Borne
Encephalitis (TBEV).
La maladie grave, en voie de dissémination en Europe occidentale, a
été reconnue comme une entité bien définie à
la suite d'épidémies survenues en Sibérie au début
des années 1930, lors de défrichages massifs. L’essentiel des
travaux de recherche a été effectué dans les pays de
l’ex-Europe de l’Est.
Dans les années 40, elle était connue en Finlande sous le nom
de "Kumlinge disease".
La souche européenne n'a été isolée qu'en 1948
en Tchécoslovaquie, lors d'une épidémie [522].
![]() Virologie
Virologie
 L’encéphalite
européenne à tiques est causée par un virus à
ARN, de très petite taille (80nm de diamètre), décrit
en 1931 par Schneider. Les soviétiques ont démontré avec
Zilbert en 1937 qu’il était transmis par la morsure d’Ixodes persulcatus,
puis avec Pavlovsky en 1939 que la maladie est étroitement liée
aux mammifères. Trois sous-types étaient décrits : Far
Eastern ((Russian Spring Summer Encephalitis [RSSE], encéphalite verno-estivale
russe encore appelée encéphalite de la taïga), Siberian
(ou West-Siberian), et Western European (Central European encephalitis [CEE]).
L’encéphalite
européenne à tiques est causée par un virus à
ARN, de très petite taille (80nm de diamètre), décrit
en 1931 par Schneider. Les soviétiques ont démontré avec
Zilbert en 1937 qu’il était transmis par la morsure d’Ixodes persulcatus,
puis avec Pavlovsky en 1939 que la maladie est étroitement liée
aux mammifères. Trois sous-types étaient décrits : Far
Eastern ((Russian Spring Summer Encephalitis [RSSE], encéphalite verno-estivale
russe encore appelée encéphalite de la taïga), Siberian
(ou West-Siberian), et Western European (Central European encephalitis [CEE]).
Récemment, il a été proposé de distinguer 4 types
de TBEV: Western (W-TBEV), Eastern (comprenant FE-TBEV et S-TBEV pour la Sibérie),
Turkish sheep, et Louping-ill [482].
Ce virus est pathogène, quelle que soit sa voie d’inoculation.
Différentes souches sont
reconnues:
Pour le TBEV/RSSE : Absettarov, Irkutsk très proche sinon similaire
à Ljubljana, Karshi, Glubinnoe/2004 ...[483]
Pour le TBEV/CEE :
Hanzalova isolée d'abord en Tchéquie,
Hypr, souche très proche sinon identique à Hanzalova, elle infecte
les mammifères et l'homme d'Europe Centrale et de Scandinavie.
Kumlinge occasionne des encéphalites en Finlande.
Neudoerfl (souche utilisée pour la vaccin Baxter) [445].
Émergence de nouvelles souches en Europe ?
Le TBEV se caractérise par son aptitude à agglutiner les hématies
(protéine HA). Ces dernières années beaucoup de souches
HA-déficientes ont été isolées de malades et d'Ixodes
persulcatus. L'analyse des séquences déficientes du génome
du TBEV a permis d'identifier 3 substitutions possibles d'acides aminés
(D67G, E122G or D277A); chacune d'entre elles accroît l'hygrophobie
du virion. De façon inattendue, chaque modification favorise la multiplication
du virus chez I. ricinus qui n'est pas normalement vecteur, de plus
elle intensifie l'efficacité du co-repas sur la souris. Rétrospectivement
la mutation D67G a été identifiée dans les encéphalites.
L'équipe qui étudie ces mutations suppose qu'elles favorisent
à la fois l'émergence de souches mieux adaptées vers
l'ouest grâce à des vecteurs inhabituels, et l'aptitude du virus
à traverser la barrière hémato-encéphalique humaine
occasionnant des formes sévères de TBE [794].
En Europe occidentale, la transmission à l’homme est
provoquée principalement par la morsure de la tique Ixodes
ricinus.
Le virus se maintient pendant des durées prolongées dans le
lait, même lors de son passage dans l’estomac. Il occasionne des "fièvre
de lait diphasiques".Thermolabile, il est facilement détruit par
la pasteurisation (chauffé 10 secondes à 72°C).
L’encéphalite européenne à tiques est
endémique dans l’ex-Europe de l’Est, où elle est causée
par le TBEV de sous-type RSSE.
Elle est sporadique en Europe occidentale, Allemagne, Grèce, Italie,
Suède, Suisse.
L'encéphalite à tiques est aussi endémique en Chine,
en Corée du Sud, au Japon, au Kazakhstan, en Mongolie... Chaque année
de nouvelles zones à risque sont déouvertes, comme en 2009 la
région de Simo (en Laponie finnoise 65°40'N, 24°54'E) où
le virus semble ne s'être installé que très récemment [949].
En France 5 à 10 cas sont dénombrés chaque année
depuis 1968.
D'abord exclusivement observés en Alsace et en Lorraine, trois cas
ont été publiés en Haute-Savoie en 2003 (Faverges et
Grenoble), un en Aquitaine en 2006, un cas a été confirmé
dans la Drôme par le CNR Arbovirus en février 2009 (Comm. perso.
non publié). À l'exception des cas bordelais et diois où
il n'a pas été possible d'exclure les autres virus appartenant
au complexe du TBEV, les infections ont toutes été occasionnée
par le TBEV de sous-type CEE [119, 464,465].

La distribution des sous-types viraux explique la variabilité
de gravité des atteintes [119], le sous-type TBEV-RSSE transmis
par Ixodes persulcatus est souvent à l’origine d'une
méningo-encéphalite sévère en ex-Union Soviétique,
avec parfois des séquelles neurologiques du type poliomyélite.
![]() Groupes
à risque
Groupes
à risque
L’essentiel de la population à risque est représenté
par les personnes exposées à la morsure de tiques, auxquelles
il faut ajouter les consommateurs de lait cru [120,121,122].

Les habitudes alimentaires de certaines populations d'Europe centrale, qui
boivent du lait cru, les exposent au risque d'infection par le TBEV. Ainsi
en 1951-1952, une épidémie affecta plus de 600 personnes en
Slovaquie, quelques cas sont survenus aussi en Autriche après ingestion
de lait de chèvre.
En 1984, les polonais estimaient que 6 % de leurs TBE étaient liées
à l' ingestion de lait de vache cru.
![]() Cette
estimation de voit renforçée par la publication en décembre
2010, d'une l'étude par RT-PCR et ELISA de 119 échantillons
de lait frais de vaches (63), chèvres (29) et brebis (27), collectés
dans 8 fermes de la région de Lublin (Pologne). Les RT-PCR montrent
une prévalence du TBEV de 22,2 % dans le lait de brebis, de 20,7 %
dans celui de chèvre et de 11,1 % dans celui de vache. La recherche
d'anticorps anti TBEV dans le lait par ELISA, trouve des prévalences
de 14,8 % dans le lait de brebis, de 3,2 % dans le lait de vache et de 0 %
dans le lait de chèvre. Ces chiffres plaident contre la consommation
de lait cru [936].
Cette
estimation de voit renforçée par la publication en décembre
2010, d'une l'étude par RT-PCR et ELISA de 119 échantillons
de lait frais de vaches (63), chèvres (29) et brebis (27), collectés
dans 8 fermes de la région de Lublin (Pologne). Les RT-PCR montrent
une prévalence du TBEV de 22,2 % dans le lait de brebis, de 20,7 %
dans celui de chèvre et de 11,1 % dans celui de vache. La recherche
d'anticorps anti TBEV dans le lait par ELISA, trouve des prévalences
de 14,8 % dans le lait de brebis, de 3,2 % dans le lait de vache et de 0 %
dans le lait de chèvre. Ces chiffres plaident contre la consommation
de lait cru [936].
Six personnes (6/7) et quatre cochons (4/4) ont été
contaminées respectivement par du fromage de chèvre au lait
cru et son petit lait en août 2008 en Autriche, il semblerait que les
chèvres aient été infectées par I. ricinus
à 1 564 m d'altitude [677, 783].
La transmission foetomaternelle est
décrite [303].
Les petits foyers épidémiques constatés chez les citadins
ont toujours pu être rattachés à des voyages en zone infestée.
La contamination du personnel de laboratoire a aussi été observée.
 Bien
qu'elle n'ait pas encore été décrite, la transmission
interhumaine est possible par transfusion sanguine.
Bien
qu'elle n'ait pas encore été décrite, la transmission
interhumaine est possible par transfusion sanguine.
Voir la page Transplantation
et transfusion
 Une
étude spatiotemporelle russe a observé le déplacement
géographique du TBEV sur quarante ans, elle a enregistré la
redistribution de la morbidité, les variations régionales dans
le temps, et la corrélation avec les variations climatiques [123].
À l’heure actuelle l’incidence de l’encéphalite à tiques
est en augmentation constante dans les foyers d’endémie [124,125,126].
Une
étude spatiotemporelle russe a observé le déplacement
géographique du TBEV sur quarante ans, elle a enregistré la
redistribution de la morbidité, les variations régionales dans
le temps, et la corrélation avec les variations climatiques [123].
À l’heure actuelle l’incidence de l’encéphalite à tiques
est en augmentation constante dans les foyers d’endémie [124,125,126].
La prévalence est difficile à chiffrer en raison de la grande
fréquence des formes frustes ou pseudo-grippales, qui représentent
au moins les trois quarts des cas [127,128]. Les infections symptomatiques
touchent indifféremment toutes les classes d’âge. Le sous-type
CEE provoque des atteintes moins graves chez l’enfant que chez l’adulte, spécialement
dans le cas des plus de 60 ans où le taux de décès varie
de 0,5 à 2 %. Le sous-type RSSE provoque des atteintes plus graves
entraînant de 5 à 20 % de décès [129].
L’immunité conférée est durable.
Carte.
Selon différentes études le climat ne suffit pas à expliquer
l'émergence du TBEV, il semblerait que les facteurs socio-économiques,
la structure de la forêt et la densité des chevreuil constituent
des éléments prédictifs importants du risque d'émergence
du TBEV [474, 681-683,686].
Actuellement la prévalence du TBEV est beaucoup plus élevée à l’est de l’Europe qu’à l’ouest. En Pologne par exemple, dans la région de Lublin, elle s’élève à 19,8% pour les ouvriers forestiers et à 32,0% pour les paysans, l’incidence de la maladie y est encore en progression constante [124]. Mais cette dissémination est aussi constatée en Europe occidentale [125,126,130, 523]. L’incidence s’élève régulièrement en Allemagne (en Bade-Wurtemberg et en Bavière) justifiant maintenant l’immunoprophylaxie des personnes à risque [125,131]. Les Länder voisins commencent d’ailleurs à recenser les premiers cas aigus, notamment la Sarre et le Palatinat qui sont à notre proximité immédiate [126]. Un premier cas mortel a été publié en Italie en 2006, chez une femme de 72 ans non vaccinée [822]. La maladie semble aussi d'étendre au Danemark où deux premiers cas ont été observés en dehors de l'ïle de Bornholm [778].
En France, le taux d’infection des tiques alsaciennes variait
de 0.4 % à 0.8 % en 1992 [8], ce qui explique la relative
rareté de l’infection dans cette région à cette époque.
Une étude a été effectuée en 1996 par la médecine
préventive lorraine sur un échantillon de 1777 personnes, la
prévalence est de 1,6 % [132]. L’incidence resterait stable
depuis une dizaine d’années [133]. Toutefois, comme l'observe
une étude réalisée en Suisse en 2011, tous les isolats
appartiennent à la souche TBEV/CEE connue pour sa virulence modérée
qui pourrait occasionner une forte proportion de formes infracliniques [976].
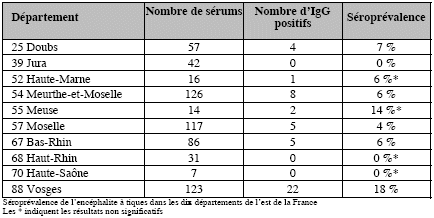
Une enquête séro-épidémiologique a été
réalisée lors du premier semestre 1989, incluant 619 professionnels
de la forêt de 10 départements de l’est de la France (CCMA,
laboratoire Immuno France et Institut de Virologie de Strasbourg). Cette étude
a mis en évidence des séroprévalences inattendues dans
les départements de la Meuse et des Vosges, accès à la
thèse
de X. Haller [303]. Toutefois le nombre restreint de prélèvements
effectués en Meuse ne permet pas de tirer de conclusions.
Voir la carte.
En Europe, la co-endémie de borréliose de
Lyme avec l’encéphalite à tiques a été constatée
en de nombreux pays, en République Tchèque, en Russie, en Pologne,
en Allemagne...
Les deux maladies partagent le même vecteur Ixodes ricinus, (ou
Ixodes persulcatus à l’est), et les mêmes hôtes
réservoirs, principalement les cervidés, les rongeurs [135]
et les oiseaux [136]. Bien que les zones de co-endémie
soient fréquentes, il faut noter que la distribution de la borréliose
et de l’encéphalite diffèrent par endroit, sans que les raisons
ne puissent encore en être précisées [134].
 L’encéphalite
à tiques est retrouvée là où les populations de
cervidés et de rongeurs sont importantes; lorsque les tiques pullulent.
L’encéphalite
à tiques est retrouvée là où les populations de
cervidés et de rongeurs sont importantes; lorsque les tiques pullulent.
Les rongeurs sont à la fois hôtes réservoirs et amplificateurs,
ils maintiennent le virus dans l'écosystème.
En raison du nombre élevé de tiques infectées qu'ils
hébergent durant toute leur vie (qui est plus longue que celle des
micromammifères), les cervidés sont beaucoup plus fréquemment
porteurs d'anticorps. Ces grands mammifères étaient jusqu'à
présent supposés n’être que des hôtes accidentels,
ne jouant pas de rôle essentiel dans le maintien de la maladie dans
la nature.
Avec la reconnaissance récente du phénomène de co-nourrissage,
il semble maintenant que leur rôle pourrait être beaucoup plus
important qu'il ne paraissait auparavant pour le TBEV/CEE [135].
Cependant l'absence locale de cervidés sur des surfaces inférieures
à un hectare se traduit par des zones à plus fort risque de
TBE, car elle contraint les tiques à se fixer sur les rongeurs. Ce
qui montre que les cervidés jouent en fait un rôle d'hôte
de dilution non négligeable [759,760].
![]() Il
n'en demeure pas moins que la structure des forêts et leur densité
en chevreuils sont des éléments prédictifs du risque
de TBE, comme cela vient d'être étudié en Italie [882].
Il
n'en demeure pas moins que la structure des forêts et leur densité
en chevreuils sont des éléments prédictifs du risque
de TBE, comme cela vient d'être étudié en Italie [882].
Le sous-type RSSE paraît quant à lui moins dépendant du
phénomène de co-nourrissage car il persiste à l'état
latent l'hiver chez les microrongeurs. Cette aptitude est cependant décrite
aussi pour le TBEV/CEE dans une zonde d'endémie en Slovaquie [934].
Les oiseaux aussi maintiennent la maladie, il a notamment été démontré que les moineaux polonais (Passer domesticus et P. montanus) sont porteurs d’anticorps contre divers arbovirus, dont le TBEV à 1,1% [136].
L'encéphalite à tiques est une pathologie qui touche essentiellement l'homme, toutefois elle atteint occasionnellement le chien et le cheval. Plusieurs cas d'infection avec la souche Neudoerfl viennent d'ête observés chez des macaques (Macaca sylvanus) vivant en milieu ouvert dans une région à risque du sud de l'Allemagne [460].
|
Prévalence du TBEv chez les vertébrés
des zones endémiques [382] |
|
| Hôtes | Prévalence en % |
| Mulot à collier (Apodemus flavicollis) | 47,9 |
| Campagnol roux (Clethrionomys gapperi) | 29,4 |
| Renard | 18,0 |
| Cervidés | 83,0 |
| Chien | 2,0 - 5,6 |
| Chèvre | 44 |
| Bovins | 35,5 - 91,0 |
On connait 14 espèces de tiques porteuses du TBEV,
mais deux sont essentiellement responsables de la transmission à l'homme,
Ixodes persulcatus et I. ricinus. Contrairement aux moustiques,
les tiques transmettent la maladie verticalement à leur descendance
[137, 307], elles demeurent infectées pendant toute leur
vie.
Le phénomène de co-repas joue un rôle très important,
il autorise la transmission du virus d'une tique infectée aux tiques
non infectées se nourrisant à proximité, sur un hôte
non virémique pouvant même possèder des anticorps. Il
dépend essentiellement de la synchronisation des nymphes et des larves.
En conséquence, la prévalence du virus par stase ne cesse d’augmenter
de l’oeuf à l’adulte. lI y a 4 fois plus d’adultes infectés
que de nymphes. La prévalence des tiques infectées par le TBEV
en Europe occidentale varie de 0,5 à 5 %, elle peut atteindre 40 %
dans certaines régions de Russie. L’incidence de l’encéphalite
à tiques est donc logiquement plus élevée en Russie,
dans les régions de l’Oural et de l’ouest de la Sibérie, elle
atteint de 115 à 199 cas pour 100 000.
La transmission du virus à l'hôte impose que la tique reste fixée à la peau au moins pendant 48 à 72 heures. Le nombre de morsures de tiques a une valeur prédictive sur la sévérité de l’infection [138].
L’incubation dure habituellement de 1 à 2 semaines, mais elle peut varier de 4 à 28 jours, avant que la maladie n’apparaisse en deux phases entrecoupées d’une période de rémission d’environ 8 jours. Quarante à 60% des patients se rappellent avoir été mordus par une tique. Le sous-type RSSE est caractérisé par une évolution monophasique. Dans le cas des contaminations alimentaires l’incubation est raccourcie à 3 ou 4 jours.
La forme biphasique commence par un syndrome grippal sévère, qui se prolonge pendant 2 à 7 jours, durant lesquels la température peut s’élever de 37,5 à 39,0°C. Aucun signe neurologique ne peut être constaté à ce moment. Cette phase est suivie d’un relatif répit de 2 à 10 jours. Dans environ 30 % des cas ce répit peut passer inaperçu.
La deuxième phase ne se manifeste que dans environ
le tiers des cas. La température est plus élevée que
lors de la première phase (de 1 à 2°C), elle dure de 4 à
10 jours. Les signes cliniques les plus fréquemment rencontrés
sont alors un faciès vultueux, l’injection des conjonctives, des céphalées,
des nausées, des somnolences et des myalgies. On peut aussi rencontrer
de temps à autre une hyperesthésie, une hyperacousie ou une
hyperosmie. L’atteinte neurologique se traduit le plus souvent par un épisode
de méningite aiguë lymphocytaire, quelquefois une encéphalite,
une méningo-encéphalite, une méningo-encéphalomyélite
ou un syndrome post encéphalitique.
Le patient peut présenter des signes d’excitation nerveuse, des tremblements
ou des convulsions. À l’inverse, il est possible de rencontrer une
confusion mentale ou un état d’apathie. L’élévation de
la température peut s’accompagner de signes de méningisme, de
parésies ou paralysie, de spasmes musculaires, d’aphasie ou de nystagmus.
Une forme fébrile pure est décrite en Russie
avec le sous-type RSSE, identique aux formes fébriles des autres infections
à Flavivirus, le patient se plaint alors d’une intense hyperthermie
associée à un syndrome grippal dépourvu de tout signe
méningé.
Sa fréquence varie de 5 à 50 % des formes symptomatiques.
Il n’y a pas de forme fébrile pure décrite avec le sous-type
CEE, peut-être en raison d’une fréquence moindre.
Le plus souvent, l’encéphalite à tiques se traduit par une méningite lymphocytaire aseptique. Le syndrome grippal est alors marqué par une fièvre élevée associée à des céphalées, vertiges et vomissements. Les signes méningés sont généralement discrets. La PL confirme la pléiocytose.
La traduction clinique de l’encéphalomyélite est variable. Habituellement la fièvre est élevée et résiste aux antipyrétiques. La fièvre de la deuxième phase peut alors se prolonger jusqu’à 1 mois. Les signes méningés sont généralement présents et les patients sont souvent somnolents obnubilés, voire inconscients. La symptomatologie la plus fréquemment observée inclut, des tremblements des extrémités et des fasciculations de la langue, des sueurs profuses et un nystagmus. L’altération des réflexes ostéo-tendineux, une ataxie et une dissociation de la sensibilité peuvent aussi être observés. La particularité clinique réside dans l’atteinte privilégiée des noyaux moteurs du tronc cérébral et de la moelle épinière, qui occasionnent des paralysies importantes des nerfs crâniens, une atteinte des muscles du cou, de la ceinture scapulaire et même des membres supérieurs. Les troubles régressent habituellement en 3 à 6 jours.
La forme la plus sévère de l’encéphalite à tiques est la méningoencéphalomyélite. Les parésies apparaissent 5 à 10 jours après la période de rémission, elles peuvent être précédées par d’intenses lombalgies et douleurs des membres. L’atteinte des nerfs crâniens et des motoneurones se traduit par une paralysie flasque du cou et de la partie haute du corps. L’extension de l’atteinte est de pronostic sombre, la mort survient alors dans les 5 à 7 jours après l’apparition des signes neurologiques, en raison de l’atteinte bulbaire ou de l’œdème cérébral.
La maladie se traduit par une méningoencéphalite chez plus des 2/3 des personnes de plus de 60 ans; alors que chez l'enfant et l'adulte jeune? elle s'exprime plus fréquemment par une méningite lymphocytaire (respectivement 66 et 64% des cas).
Des cas de méningoencéphalite à tiques
associés à un syndrome hémorragique ont été
décrits dans la région de Novosibirsk en 1999. Ils ont occasionné
8 décès [381].

Un cas de myélite isolée, sans signe de méningite ou
de méningo-encéphalite vient d'être publié en Allemagne
chez un homme de 43 ans [438]. Ce cas inhabituel doit être
gardé en mémoire, notamment dans le cadre du dianostic différentiel.
Séquelles
Le sous-type RSSE occasionne des atteintes et des séquelles
plus importantes que le sous-type CEE, les parésies séquellaires
sont constatées dans 10 à 20 % des cas avec la même gravité
pour les enfants que les adultes.
Avec le sous-type CEE la fréquence des parésies varie de 2 à
10 % , et les enfants de moins de 4 ans présentent rarement des atteintes
graves du SNC.
Les Russes décrivent une forme chronique associée au virus TBEV-RSSE, où les lésions des motoneurones continuent à s’aggraver de manière progressive ou intermittente. Il est encore difficile dans ces cas de faire la part entre infection chronique, auto-immunité et co-infections possibles [141].
Dans les pays de l’est de l’Europe de fréquentes co-infections sont constatées avec la borréliose de Lyme [142,143,144,145]. J. Cimperman qui a étudié 12 cas de co-infection, décelés sur une série 338 cas de méningite aiguë lymphocytaire, note que 8 des 12 patients ont développé la symptomatologie de borréliose de Lyme dans les suites de l’encéphalite à tiques [144]. En l’absence d’ECM, le diagnostic de borréliose de Lyme ne peut alors être que sérologique [141].
Les études séro-épidémiologiques effectuées à nos frontières du nord-est jusqu’à l’Italie montrent une augmentation progressive de la prévalence du TBEV et une co-prévalence avec la borréliose de Lyme, la babésiose et l’ehrlichiose granulocytique. Toutes ces pathologies sont susceptibles de co-infecter l’encéphalite européenne à tiques. Elles doivent entrer dans le diagnostic différentiel, en raison des similitudes de groupe à risque, de répartition géographique, et même de symptomatologie clinique.
![]() Diagnostic
différentiel [303]
Diagnostic
différentiel [303]
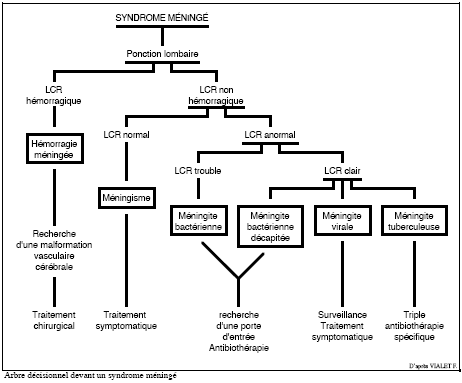
Contrairement aux ménigites bactériennes, le tabeau clinique
initial des méningites virales n'est pas univoque, car il est lié
à une multitude d'étiologies possibles. Les signes cliniques
sont cependant les mêmes (fièvre, céphalées, vomissements,
raideur de la nuque), avec un état général généralement
peu altéré. Souvent, les céphalées sont plutôt
fronto-orbitaires, les signes méningés plus discrets, et la
raideur de nuque plus modérée [305]. Habituellement,
la survenue d'une méningite ou d'une méningo-encéphalite
aiguë aseptique ne peut que rarement être associée d'emblée
à une morsure de tique.
La mise en oeuvre d'un traitement étant conditionnée
par l'orientation diagnostique, il est nécessaire de commencer par
procéder à l'anmèse et à l'examen clinique du
patient.
Un scanner crânien doit être demandé (pour éliminer
l'hypothèse d'un abcès), ainsi qu'une cohorte d'examens biologiques
(IDR à la tuberculine, sérodiagnostics viraux (entérovirus,
HSV2 ou 1, HIV, varicelle-zona, cytomégalovirus, oreillons, rougeole…
Flaviviridae selon l'anamnèse).
En cas d'exposition aux morsures de tiques, des sérologies de borréliose
de Lyme, de rickettsioses, coxiellose, anaplasmose, d'arboviroses comprenant
bien sûr le TBEV devraient être systématiquement demandées.
L'exament clé demeure cependant la PL (ponction lombaire) : aspect
macroscopique, analyse chimique, bactériologique et immunologique du
liquide céphalorachidien (LCR). Voir Diagnostic
des méningo-encéphalites.
Le virus TBE peut être isolé en tout début de maladie dans le sang (virémie de dissémination), puis dans le LCR du patient. La PL permet d’examiner un LCR hypertendu clair, le taux de glucose est normal, celui des protéines montre une élévation modérée et il existe une pléiocytose. Au début de la maladie, le compte des cellules peut monter jusqu’à 1 000/mm3 avec une prédominance des cellules mononuclées, comme dans les méningites bactériennes. La pléiocytose dure habituellement de 3 à 6 semaines, mais elle peut persister jusqu’à 4 mois.
Les examens sanguins restent habituellement normaux, mais on peut quelquefois remarquer une polynucléose neutrophile (maximum 15 000 /mm3) au tout début de la maladie. Une neutropénie associée à une thrombopénie et à une élévation modérée des enzymes hépatiques a été décrite en début de maladie [146]. La Protéine C réactive et la VS ne sont modifiées que lors des atteintes graves.
Le diagnostic repose surtout sur la sérologie effectuée
par test d’immuno-capture, l’accroissement du taux d’IgM spécifiques
lors de deux prélèvements successifs à 2 semaines confirme
le diagnostic. À noter qu’il existe une réaction croisée
avec les autres flavivirus, et que les IgM ne persistent que quelques semaines.
La sérologie présente l'inconvénient d'être tardive
et croisée. La biologie moléculraire apporte une aide considérable
avec la nRT-PCR. Son intérêt principal tient dans la détection
précoce de l'ARN viral durant la virémie transitoire de la première
semaine de l'infection. Elle permet ainsi d'étayer, ou de réfuter,
précocement le diagnostic, puis d'adopter les mesures nécessaires.
Dans les zones où cohabitent différents sub-types de TBEV, elle
permet de les distinguer [601].
Les données anatomo-pathologiques ne peuvent éclairer le diagnostic
que sous un jour rétrospectif.
Les scanner et IRM cérébraux ne sont pas plus contributifs.
![]() Cas
possible Tableau clinique compatible (fièvre avec symptômes
neurologiques de méningite ou d'encéphalite aseptique) ET
installation de la maladie durant la période d'activité des
tiques (avril à novembre).
Cas
possible Tableau clinique compatible (fièvre avec symptômes
neurologiques de méningite ou d'encéphalite aseptique) ET
installation de la maladie durant la période d'activité des
tiques (avril à novembre).
![]() Cas
probable Cas possible ET exposition aux morsures de tiques
d'une zone d'endémie durant les 6 semaines précédant
la maladie.
Cas
probable Cas possible ET exposition aux morsures de tiques
d'une zone d'endémie durant les 6 semaines précédant
la maladie.
OU Détection d'IgM spécifiques dans le sérum,
sous réserve de ne pas avoir subi de vaccination contre des Flavivirus
dans les 3 mois précédant la maladie.
![]() Cas
confirmé Cas possible ET détection d'IgM ou d'IgG spécifiques
dans le LCR
Cas
confirmé Cas possible ET détection d'IgM ou d'IgG spécifiques
dans le LCR
OU accroissement d'au moins 4 fois du titre d'anticorps (en l'absence
de vaccination anti-Flavivirus dans les 3 mois précédant la
maladie).
OU Isolement du virus dans les tissus, le sang ou le LCR du patient.
Il n’existe pas de traitement autre que symptomatique, les antipyrétiques et anti-inflammatoires non stéroïdiens sont habituellement utilisés associés à un repos au lit pendant 2 semaines. Dans les formes graves la corticothérapie a été proposée. Les Russes auraient obtenu des améliorations cliniques avec l’injection d’immunoglobulines spécifiques, ces études demandent à être confirmées [147].
La prophylaxie peut être assurée très
efficacement par Ticovac®. Ce vaccin inactivé est destiné
aux adultes et aux enfants à partir de 3 ans, dans les zones à
haut risque conformément aux recommandations officielles. Deux injections
espacées d’un mois sont nécessaires, suivies d’un premier rappel
à un an, puis tous les 3 ans. Sa tolérance est bonne, si l’on
excepte quelques fièvres post-vaccinales. Son efficacité serait
supérieure à 95 %, tant pour le sous-type CEE que pour le RSSE.
Il est souhaitable de pratiquer ce vaccin au moins neuf mois avant l’exposition
au risque, de préférence à la saison froide. Ticovac®
est maintenant disponible en pharmacie. D’autres vaccins, un allemand et deux
russes, apporteraient une efficacité équivalente.
La lettre de TBE info de juin 2008 (TBE-IgG-Antibody
response to a single dose of FSME-IMMUN Adults* in subjects with a history
of incomplete and/or irregular TBE vaccination) montre qu'une seule
vaccination procure une immunité durable dans 93,9 % des cas, alors
que 2 ou plusieurs portent l'efficacité à 98 %. Ce qui
devrait inciter à modifier notre regard sur le schéma de vaccination
[529].
![]() La même Lettre
de décembre 2009 précise que 18 % des personnes âgées
vaccinées présentent un taux d'anticorps insuffisant et qu'il
peut être nécessaire d'envisager une troisième injection
si le taux n'est pas protecteur [821].
La même Lettre
de décembre 2009 précise que 18 % des personnes âgées
vaccinées présentent un taux d'anticorps insuffisant et qu'il
peut être nécessaire d'envisager une troisième injection
si le taux n'est pas protecteur [821].
La relative rareté de l’affection ne justifie pas d’envisager de
vaccination systématique en France, même dans les populations
à risque. Le vaccin doit par contre être proposé aux voyageurs
des zones à haut risque. Surtout lors de séjours dans la nature
en Europe Centrale (notamment en Autriche) et en Europe Orientale.
Des immunoglobulines spécifiques d’origine humaine
étaient disponibles en Autriche, jusqu'à ce que le programme
de vaccination autrichien autorise l'arrêt de leur production. Ces immunoglobulines
pouvaient être utilisées dans les quatre jours suivant la morsure
de tique en zone d’endémie, chez les patients non préalablement
vaccinés (FSME-Bulin ®). Elles pouvaient alors être
obtenues en France dans le cadre d’une ATU [148].
Toutefois, l'efficacité de ce traitement onéreux est controversée.
Les mesures d’évitement des morsures de tiques restent essentielles.
Pour plus d'information voir :
 Haller
X. Méningoencéphalite
à tiques. Les cas alsaciens, le point en 1991. Faculté de Médecine
de Strasbourg. Thèse de médecine générale
[303].
Haller
X. Méningoencéphalite
à tiques. Les cas alsaciens, le point en 1991. Faculté de Médecine
de Strasbourg. Thèse de médecine générale
[303].
de Marval F Etude
séroépidémiologique de l'encéphalite à
tiques et de la borréliose de Lyme en Suisse [444].
Focosi D. Tick
borne encephalititis virus (site accédé 21 10 10)
Baxter Monograph Tick-borne
encephalitis (TBE FSME)
La
Méningo-encéphalite à tiques : un risque méconnu.
 Le
virus Eyach (EYAV) a été isolé en 1972 dans le
Bade-Wurtemberg (Allemagne) à partir d’Ixodes ricinus. Il est
observé pour la première fois en France en 1981, dans la Mayenne.
Ce virus, tout comme celui de la fièvre à tiques du Colorado
(CTF), appartient au genre Coltivirus de la famille des Reoviridæ.
Le
virus Eyach (EYAV) a été isolé en 1972 dans le
Bade-Wurtemberg (Allemagne) à partir d’Ixodes ricinus. Il est
observé pour la première fois en France en 1981, dans la Mayenne.
Ce virus, tout comme celui de la fièvre à tiques du Colorado
(CTF), appartient au genre Coltivirus de la famille des Reoviridæ.
Les trois souches isolées en France à partir de broyats de tiques
sont pathogènes, provoquant une encéphalite aiguë chez
les souriceaux inoculés. Les souches françaises diffèrent
de l’allemande par leurs propriétés immunologiques.
Dans l’ouest de la France, le réservoir est constitué par les lapins de garenne. Les tiques qui ont permis l’isolement du virus avaient d’ailleurs été prélevées sur un lapin trouvé mort. L’étude sérologique de 93 micromammifères n’a trouvé aucun anticorps anti-Eyach. Par contre des anticorps ont été retrouvés sur les cerfs dans l’est de la France, et aussi sur des chamois et des moutons sauvages. En Sarre, les mulots et les campagnols pourraient constituer le réservoir de virus [118]. La présence de ce virus est démontrée en France, Allemagne, aux Pays Bas et en République Tchèque.
![]() Clinique
Clinique
Le virus EYAV ne s’est vu reconnaître une pathogénicité
humaine que depuis quelques années en Bohème, avec la découverte
d’anticorps anti-Eyach chez 25 patients souffrant d’affections neurologiques
(polyradiculonévrites, méningoradiculites).
Pour l'heure sa symptomatologie clinique demeure encore mal connue, mais il
est très probable qu'à l'instar de la fièvre à
tiques du Colorado, ou des autres arboviroses à tiques, elle demeure
confondue avec d'autres maladies à tiques, des arboviroses à
moustiques ou des ménigites lymphocytaires aiguës [835].
La symptomalogie clinique de l'infection à EYAV ressemble sans doute
à la fièvre à tiques du Colorado dont le virus est très
proche en voici donc une description sommaire :
Clinique de la fièvre à tiques du Colorado
L'infection humaine par le CTFV est caractérisée par l'apparition
brutale de fièvre accompagnée de tremblements et céphalées
surtout rétro-orbitaires, photophobie, myalgies, douleurs abdominales
et malaise général. Une fièvre bi ou triphasique peut
être observée sur une durée de 5 à 10 jours. Les
formes sévères sont compliquées d'atteintes du système
nerveux central, de fièvres hémorragiques, de péricardite
ou de myocardite; des orchites ont été observées chez
l'enfant. La transmission foeto-maternelle est établie, le virus est
tératogène chez la souris. Vingt pour-cent des cas seraient
hospitalisés, mais moins de 7 % donneraient lieu à des complications.
![]() Diagnostic
Diagnostic
Dans les 2/3 des cas l'infection occasionne une leucopénie et une thrombopénie.
Lors des atteintes neurologiques, l'examen du LCR trouve des lymphocytes et
le virus peut y être isolé. La détection du EYAV est maintenant
possible par RT-PCR basée sur la séquence du segment 12 de son
génome (Attaoui H, 1998).
Les sérologies de détection d’anticorps spécifiques
ELISA et Western Blot permettent d'étayer le diagnostic.
Le CTFV peut aussi être isolés dans les érythrocytes circulants
pendant une durée allant jusqu'à 4 mois.
 Tout
comme le CTFV, le virus Eyach se multiplie dans les érythrocytes
humains [118, 502, 508]. La contamination par transfusion sanguine
est tout à fait vraisemblable.Voir la page Transplantation
et transfusion
Tout
comme le CTFV, le virus Eyach se multiplie dans les érythrocytes
humains [118, 502, 508]. La contamination par transfusion sanguine
est tout à fait vraisemblable.Voir la page Transplantation
et transfusion
Le virus Erve (ERV) a été isolé
dans la Mayenne en 1982, sur des musaraignes prélevées sur le
bord de la rivière Erve. Il a la même distribution géographique
que le virus Eyach. Zeller a démontré en 1988, que ce
virus est étroitement apparenté au virus Thiafora.
Il est également apparenté au virus de la fièvre hémorragique
Congo-Crimée qui est connu pour son extrême dangerosité,
et que l’on peut rencontrer dans le Sud de la France.
Le virus Erve est actuellement classé dans le genre des Nairovirus (ayant les tiques pour vecteurs habituels), groupe sérologique Thiafora-Erve, famille des Bunyaviridæ. Tous sont des virus de niveau de confinement IV.
Le vecteur n’a pas encore été identifié,
il pourrait s'agir de Dermacentor. Malgré le prélèvement
de plus de mille tiques dans le foyer naturel d’infection, C. Chastel n’est
pas parvenu à isoler le virus chez les tiques ; il relate cependant
qu’elles sont particulièrement nombreuses en Sarre, là où
des cas d’infection à virus Erve ont été diagnostiqués
[118].
En 2000, R.Woessner et al. ont testé 396 petits mammifères
dont 5 se sont avérés porteurs d'anticorps contre le ERV. Dans
l'hypothèse d'une transmission par les tiques, ils ont étudié
les sérums de 955 jeunes hommes dont 62 étaient positifs pour
la borréliose de Lyme, mais ils n'ont par contre trouvé aucun
anticorps pour confirmer [620].
Le réservoir de virus identifié par étude sérologique, est constitué de multiples hôtes vertébrés, la taupe, le mulot, le sanglier, le cerf rouge, le mouton sauvage et le goéland argenté en font partie. Par contre le lapin de garenne, le renard et le chamois paraissent indemnes. En Sarre, des anticorps ont également été retrouvés chez le campagnol roussâtre.
Une étude menée sur les donneurs de sang de l’ouest de la France en 1989, montre que la prévalence s’élève à 11,38 % pour les donneurs résidant près du foyer d’infection, alors qu’elle est réduite à 2,74 % pour ceux qui en sont éloignés.
En Sarre, A. Haass a publié une enquête en
double aveugle impliquant clairement la responsabilité neuro-pathogène
du virus Erve. Les sérums de 284 malades et de 205 donneurs
de sang ont été comparés, mettant en évidence
des anticorps contre le virus Erve dans:
4,3 % des cas d’hémorragie cérébrale et 13,9 % des céphalées
sévères («Thunderclap headache»), contre 1 dans le groupe témoin
[149]. En France 4 patients se sont révélés
porteurs d’anticorps contre le virus Erve.
Lors de tout syndrome neurologique fébrile inexpliqué, survenant chez un patient à risque, il serait judicieux de pratiquer systématiquement des examens sérologiques pour le virus Erve et Eyach, incluant immunofluorescence indirecte, test ELISA et Westernblot [118, 308].
![]() Virologie
Virologie
La fièvre hémorragique
de Congo-Crimée (Congo-Crimean haemorrhagic fever, ou CCHF en anglais)
est une zoonose virale majeure, souvent mortelle chez l’homme. C'est
la maladie à tiques possédant la plus large aire de répartition
géographique, une trentaine de pays correspondant à la distribution
des espèces de Hyalomma.
La maladie a été identifiée pour la première fois
en Crimée dans les années 1945-1946. Les russes avaient alors
établi, sur des volontaires, que l'agent causal de la maladie était
filtrable et qu'il était associé à la morsure de Hyalomma
marginatum. L'agent, supposé être un virus, avait été
détecté chez la tique à ses différentes stases,
ainsi que dans le sang de patients fébriles. Cependant, dans l'incapacité
de la conserver, la souche a été perdue.
Le virus Congo a été isolé
en 1956, au Zaïre, chez un patient fébrile. Puis une douzaine
de cas a été publiée en 1967 (Simpson et al.),
cinq d'entre eux étaient consécutifs à une contamination
de laboratoire. Par la suite, en 1969, Casals a établi que les souches
eurasiennes et africaines étaient en fait similaires, donnant le nom
de Congo-Crimée au virus.
Le virus de Congo-Crimée (CCHFV)
est un Nairovirus appartenant à la famille des Bunyaviridae.
Il s'agit d'un arbovirus sphérique, possédant un ARN enveloppé,
et mesurant de 90 à 100 nm de diamètre. Il se réplique
dans la cellule sans la tuer.
Comme l'ensemble des ribovirus, il possède une capacité d’évolution
importante.
Ce virus est sensible aux UV (1 mn), il est détruit par la chaleur
(20h à 37°C, 2h à 45°C, 10 mn à 56°C). Les
solvants des lipides (chloroforme, éther, formol…), l’eau
de javel et les détergents assurent une désinfection efficace.
![]() Épidémiologie
Épidémiologie
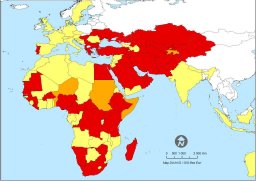 Le
CCHFV est rencontré en Afrique, en Asie et en Europe, surtout dans
sa partie orientale. (Document
EpiSouth)
Le
CCHFV est rencontré en Afrique, en Asie et en Europe, surtout dans
sa partie orientale. (Document
EpiSouth)
Des foyers sont régulièrement observés dans plusieurs
anciennes républiques soviétiques de l’Ouest et de la mer
Caspienne (Crimée, Astrakhan, Rostov, Géorgie [872]). Des
études séro- épidémiologiques ont mis en évidence
le CCHFV en Turquie dès les années 70.
Le premier cas humain en Turquie a
été identifié chez un patient contaminé en 2002.
La fréquence des cas s'y accroît depuis [388, 595].
Dans les provinces de l’Est (Anatolie) la séro-prévalence
atteint 12,8% des personnes exposées (N =782) généralement
il s'agit de patients âgés de plus de 40 ans [665-667].
L’incidence de la maladie est maintenant énorme, ProMed rapporte
147 décès depuis 6 ans, dont 55 pour la seule année 2007.
Les facteurs de l’émergence sont mal connus, cependant une enquête
menée en 2006 sur 91 patients, montre que l'actuelle émergence
du CCHF en Turquie pourrait résulter de l'amplification du virus par
le réservoir animal sauvage local plutôt que de l'importation
de pays voisins [458, 505].
Des cas sporadiques sont observés
dans les Balkans (ex-Yougoslavie, Bulgarie, Albanie [387, 506, 521, 862,
863]). Le virus est isolé occasionnellement au Portugal, en Grèce
[594], en Hongrie, en Albanie [446, 862] et aussi en
France.
Un premier décès a été enregistré dans
la province de Macédoine-Orientale-et-Thrace (Grèce frontalière
avec la Turquie et avec la Bulgarie), en juin 2008. Dans les 2 mois précédents,
la Turquie dénombrait 37 morts [624] et la Bulgarie observait
un décès parmi 4 cas confirmés et 2 possibles groupés
; 2 cas étaient liés à la manipulation de tiques à
mains nues, 2 autres cas étaient liés au contact direct avec
le cas index [680].
Des cas cliniques sont quelquefois aussi importés, comme cela fut le
cas en novembre 2004 à Rennes [389,619].
Le changement climatique et l'importation aviportée régulière
d'espèces de Hyalomma en Europe occidentale nous exposent à
leur naturalisation et au risque
émergentiel [623,892]. Certaines espèces de Hyalomma
sont suspectées d'étendre leur aire de répartition au
sud de l'Europe [625].
Hyalomma m. marginatum est présent dans le Sud-Ouest de la France
et en Corse. LG. Neumann de l'École Nationale Vétérinaire
de Toulouse signalait déjà sa présence dans le sud-ouest
en 1911 (Das Tierreich. Ixodidae)
Hyalomma m. marginatum et H. lusicatum
ont été observé naguère dans le delta du Rhône
[859].
La prévalence de la maladie est plutôt
saisonnière, avec un pic en été.
Son incidence réelle est probablement plus élevée, car
on estime qu’une personne infectée sur 5 développe la maladie.
La morbidité est plus élevée en milieu hospitalier, lors
de contamination nosocomiale.
Le taux moyen de mortalité atteint 15 % (10 % en milieu naturel à
50 % en milieu hospitalier).
L'émergence
de la maladie est liée à des causes anthropiques bien établies
: en Crimée, la pullulation du lièvre après l'interdiction
de la chasse dans l'immédiate après-guerre; en Astrakhan, la
régulation du cours de la Volga dont les crues régulaient les
populations de Hyalomma marginatum. Comme en Crimée,
il semble qu'en Turquie l'abandon des terres d'Anatolie, sous la pression
de groupes terroristes des années 1995 à 2002, a provoqué
la prolifération des lièvres et des sangliers, puis celle des
Hyalomma m. marginatum [673]. En Grèce, il semble
que l'augmentation de prévalence de la maladie depuis 20 ans est liée
à la translocation du bétail autant qu'aux modifications climatiques [933].
![]() Groupes
à risque
Groupes
à risque
Comme les autres maladies à tiques, cette arbovirose
affecte avant tout les personnes en contact avec la faune sauvage. L’Homme
est infecté par la morsure d'une tique, elle-même contaminée.
Les Hylomma de différentes espèces sont les principaux
vecteurs du virus.
Bien que les tiques jouent un rôle très important de réservoir
et de vecteur du CCHFV, elles ne sont pas l'unique source de contamination
puisqu'il a été montré en Turquie et en Iran qu'il fallait
élargir le groupe à risque aux personnes au contact du sang
ou des viscères du bétail (personnel d'abattoirs, bouchers,
fermiers et leurs compagnes). En conséquence le diagnostic de la maladie
doit être évoqué devant un tableau clinique compatible
même hors de l'aire de répartition du vecteur [971, 972].
 Parallèlement,
la CCHF peut aussi être transmise par les fluides biologiques des personnes
malades. De nombreux mammifères et oiseaux domestiques
et sauvages sont soupçonnés d’entretenir l’infection
naturelle et de constituer la principale source d’infection du vecteur.
L'infection de l'homme se produit alors par contact ; les employés
des abattoirs, les exploitants agricoles, les vétérinaires sont
particulièrement exposés à ce risque. Le risque de diffusion
nosocomiale du
virus est donc particulièrement important, il n'épargne pas
le personnel de santé.
Parallèlement,
la CCHF peut aussi être transmise par les fluides biologiques des personnes
malades. De nombreux mammifères et oiseaux domestiques
et sauvages sont soupçonnés d’entretenir l’infection
naturelle et de constituer la principale source d’infection du vecteur.
L'infection de l'homme se produit alors par contact ; les employés
des abattoirs, les exploitants agricoles, les vétérinaires sont
particulièrement exposés à ce risque. Le risque de diffusion
nosocomiale du
virus est donc particulièrement important, il n'épargne pas
le personnel de santé.

Le risque transfusionnel est bien connu [565,567].
Voir la page Transplantation
et transfusion
![]() Réservoir
de germes
Réservoir
de germes
.jpg)
Hyalomma
m. marginatum, le vecteur principal du CCHFV, est une espèce exophile
ditrope, comme le sont quelques espèces ayant dû s'adapter à
des milieux particulièrement difficiles.
Ce comportement se traduit par le fait que la larve se
gorge, mue en
nymphe puis se gorge à nouveau sur un seul et même hôte,
sans le quitter. Généralement il s'agit d'un lièvre ou
un oiseau. Ce temps prolongé passé sur l'hôte revêt
la plus grande importance si l'on considère que la tique optimise ainsi
son aptitude à être dispersée par les oiseaux migrateurs.
Le CCHFV peut
infester différents genres de tiques (notamment Hyalomma plumbeum,
H.marginatum, Rhipicephalus sanguineus, Dermacentor marginatus
ou Boophilus calcaratus). Cependant les vecteurs les plus efficaces
et les plus courants semblent appartenir au genre Hyalomma (Photo CDC).
La compétence d'Amblyomma variegatum,
si elle se confirmait, pourrait avoir
des conséquences épidémiologiques très importantes.
Le virus est maintenu dans la nature, notamment en période hivernale,
par transmission verticale (transtadiale, transovarienne) et par voie sexuelle
chez certaines espèces de vecteur, notamment les Hyalomma sp,
Dermacentor sp et Rhipicephalus sp.
Contrairement au TBEV, la transmission du CCHFV par co-repas paraît
très limitée
chez Hyalomma truncatum : elle ne serait efficace que dans environ
7% des cas (contre 72% pour le TBEV);
le virus serait donc de ce fait moins sensible au changement climatique [892].
La transmission horizontale s'effectue entre vecteurs et divers animaux sauvages
ou domestiques sensibles à l’infection. Ovins, caprins, bovins,
équins servent très probablement d’hôtes amplificateurs
en infectant un grand nombre de vecteurs lors de leur phase virémique.
Des anticorps ont été détectés chez eux, alors
qu'ils demeurent totalement asymptomatiques.
L’Homme est d'ailleurs probablement l’unique espèce sensible
qui développe la maladie.
La distribution du CCHFV coïncide totalement avec celle de son vecteur Hyalomma.
La maladie se présente comme un syndrome grippal aigu associé
à un syndrome hémorragique. Elle survient le plus souvent de
2 à 7 jours après une morsure de tique (dans les 9 jours au
maximum). L'incubation après contact avec du sang, ou des tissus contaminés,
est en général de 5 à 6 jours, mais peut se prolonger
jusqu'à un maximum documenté de 13 jours.
L'apparition des symptômes est brutale associant fièvre, myalgies,
vertiges, méningisme, courbatures, céphalées et photophobie.
Différents signes digestifs et des maux de gorge, sont parfois
observés. La fièvre est intermittente et dure généralement
de 9 à 14 jours. La moitié des malades présente une pneumonie
radiologique, associée à une discrète toux.
Les jours suivants, le patient peut présenter de brutales sautes
d'humeur, parfois même une confusion et de l'agressivité.
Entre les 2ème et 5ème jours d'évolution, ces troubles
de l'humeur font place à une asthénie, à des hépatalgies
associées à une hépatomégalie, à des adénopathies
et à une tachycardie. Le syndrome hémorragique se manifeste
d'abord par une éruption pétéchiale cutanéo-muqueuse.
Les pétéchies peuvent aboutir à la formation d'ecchymoses,
ou à la survenue d'un méléna, d'une hématurie,
d'une épistaxis, voire de saignements des gencives. Dans les cas les
plus graves, les patients développent une insuffisance hépatique,
rénale et pulmonaire. Le taux de mortalité est de l'ordre de
30 %, la mort survient au cours de la deuxième semaine de maladie,
par hémorragie digestive ou par collapsus [872].
Pour les autres patients, l'état général commence à
s'améliorer à partir du neuf ou dixième jour d'évolution.
La température et les saignements disparaissent entre les 10ème
et 20ème jours, mais la convalescence se prolonge au delà de
4 semaines.
![]() Diagnostic
Diagnostic
Le diagnostic de fièvre hémorragique de Congo-Crimée
se pratique dans des laboratoires spécialisés avec un niveau
élevé de sécurité biologique
(Groupe 4, selon l'arrêté du 18 juillet 1994).
Le diagnostic de la maladie repose sur la sérologie ELISA ou EIA.
Les IgM apparaissent approximativement à partir du sixième
jour de la maladie et persistent pendant 4 mois. Les IgG restent détectables
pendant environ 5 ans.
Dans les cas mortels, la production d'anticorps est généralement
insuffisante pour être détectée. Le virus peut alors être
isolé dans le sang ou les tissus, dans les cinq premiers jours de la
maladie. Les antigènes viraux peuvent aussi être mis en évidence
dans les échantillons tissulaires par immunofluorescence ou immuno-enzymologie.
L'amplification génique (PCR) est également
possible [466].
![]() La charge virale semble avoir un intérêt prédictif sur
l'évolution de la maladie. Une charge supérieure à 1
x 109 copies d'ARN/mL serait prédictive d'une issue fatale
dans 80% des cas (88,9% de sensibilité et 92,6% de spécificité)
[531].
La charge virale semble avoir un intérêt prédictif sur
l'évolution de la maladie. Une charge supérieure à 1
x 109 copies d'ARN/mL serait prédictive d'une issue fatale
dans 80% des cas (88,9% de sensibilité et 92,6% de spécificité)
[531].
![]() Traitement
Traitement
Comme pour les autres viroses, le traitement de la fièvre hémorragique
de Congo-Crimée demeure symptomatique. Il comprend essentiellement
la surveillance de la volémie et les transfusions sanguines.
L'emploi de la ribavirine semble améliorer le pronostic, surtout orsqu'il
est administré précocement [668, 669]. Ce qui ne
parait pas être le cas des plasmas immuns prélevés sur
des patients convalescents.

Le CCHFV présente toutes les qualités requises pour faire partie
des agents biologiques "militarisables".
Il justifie de ce fait une surveillance encore plus attentive.

Les sérums doivent être testés en fonction de l'origine
géographique de l'infection. C'est la raison pour laquelle ils doivent
toujours être accompagnés par une
fiche de recueil des renseignements comportant toutes les informations
épidémiologiques et cliniques nécessaires.
Pour plus d'information voir :

The Center fot Food Security and Public Health .Crimean-Congo
Hemorrhagic Fever. 2007 [507].
Charrel RN et al.Tick-borne
virus diseases of human interest in Europe 2004 [508].
EpiSouth Epidemiology
of Crimean–Congo haemorrhagic fever virus: Albania, Bulgaria, Greece,
Islamic Republic of Iran, Kosovo, Russian Federation, Turkey. 1st October
2008. en
français.
Ergonul O. Congo-Crimean
Hemorrhagic Fever
![]()
D'autres arboviroses
sont aussi connus en Europe pour être transmis par la morsure d'I. ricinus,
mais leur importance en termes de Santé publique est moindre: les virus
Tribec et Tettnang.
Virus Tribec
Le virus Tribec est un Orbivirus qui a été isolé pour
la première fois chez I. ricinus en Slovaquie. Dans la région
du mont Tribec, le virus circule chez les rongeurs, les chèvres et
I. ricinus à toutes ses stases. Vingt patients ont présenté
une fièvre associée à une méningo-encéphalite
ou une autre neuropathie avec des anticorps contre le virus Tribec. Le virus
a été isolé au Belarus, en Estonie, France, Tchéquie,
Hongrie, Italie, Moldavie, Norvège, Roumanie, Russie et Ukraine [922].
Virus Tettnang
Trois souches de ce virus ont été isolées chez I.
ricinus en Tchécoslovaquie, les isolats se sont montrés
léthaux pour les souriceaux (Kosuch et al. 1978). "Le soit-disant
virus Tettnang serait en fait le virus de l'hépatite de la Souris (Coronavirus),
à l'origine de nombreux faux isolements, notamment à partir
de tiques" [299].
Le virus a été isolé du LCR d'un nourrisson de 18 mois
qui souffrait de pharyngite associée à un méningisme
(Malkova et al. 1980), mais peu d'autres cas ont été
relatés et compte tenu de l'aire de répartition réduite
du virus le risque pour la Santé publique peut être considéré
comme très limité [922].
Les tiques
en ville
 Les
tiques ont la réputation d'infester les milieux forestiers et ruraux,
mais leur présence dans les régions côtières et
en ville est le plus souvent ignorée. Pourtant, les oiseaux de mer
sont fréquemment parasités par Ixodes
uriæ et Ornithodoros
maritimus. Ces acariens sont vecteurs de différents agents
pathogènes, dont des virus qu'ils peuvent transmettre à l'Homme.
Les réserves ornithologiques de la côte bretonne sont particulièrement
concernées par ces arboviroses, en raison de leurs fortes populations
d'oiseaux ; mais la côte méditerranéenne n'est pas indemne.
Les personnes s'exposent au risque en allant au contact des oiseaux, que ce
soit pour des raisons professionnelles (comme les gardes, ornithologues, naturalistes
ou photographes) ou pour des activités de loisir.
Les
tiques ont la réputation d'infester les milieux forestiers et ruraux,
mais leur présence dans les régions côtières et
en ville est le plus souvent ignorée. Pourtant, les oiseaux de mer
sont fréquemment parasités par Ixodes
uriæ et Ornithodoros
maritimus. Ces acariens sont vecteurs de différents agents
pathogènes, dont des virus qu'ils peuvent transmettre à l'Homme.
Les réserves ornithologiques de la côte bretonne sont particulièrement
concernées par ces arboviroses, en raison de leurs fortes populations
d'oiseaux ; mais la côte méditerranéenne n'est pas indemne.
Les personnes s'exposent au risque en allant au contact des oiseaux, que ce
soit pour des raisons professionnelles (comme les gardes, ornithologues, naturalistes
ou photographes) ou pour des activités de loisir.
 Les
tiques ont été importées en ville par les oiseaux, qui
se sont adaptés. Les
goélands ont apporté I. uriæ et O. maritimus
avec leurs agents pathogènes. Les pigeons et leurs nids sont infestés
d'Argas reflexus
susceptibles de transmettre des bactéries, des virus, et de provoquer
des réactions d'envenimation, des crises d'asthme, voire des chocs
anaphylactiques [199, 313]. Les sujets à risque sont à
rechercher parmi les occupants
des étages supérieurs de l'habitat urbain ancien, là
où s'établissent les colonies de pigeons.
Les
tiques ont été importées en ville par les oiseaux, qui
se sont adaptés. Les
goélands ont apporté I. uriæ et O. maritimus
avec leurs agents pathogènes. Les pigeons et leurs nids sont infestés
d'Argas reflexus
susceptibles de transmettre des bactéries, des virus, et de provoquer
des réactions d'envenimation, des crises d'asthme, voire des chocs
anaphylactiques [199, 313]. Les sujets à risque sont à
rechercher parmi les occupants
des étages supérieurs de l'habitat urbain ancien, là
où s'établissent les colonies de pigeons.
La morsure des tiques ornithophiles est souvent associée
à l'apparition, dans l'heure qui suit, d'un prurigo intense associé
à des lésions érythémateuses, nécrotiques
ou vésiculeuses, d'évolution bulleuse ou ecchymotique. Ces lésions
cutanées sont la conséquence de réactions
toxico-allergiques qui peuvent provoquer l'apparition d'une fièvre.
Cette morsure peut aussi inoculer des arbovirus à l'origine d'un syndrome
fébrile atypique pouvant durer soit moins de 8 jours, soit de deux
à sept semaines; une rhinopharyngite peut y être associée.
La symptomatologie peu spécifique rend tout diagnostic de certitude
illusoire, à moins de disposer d'informations très précises
sur le contexte épidémiologique et d'un diagnostic virologique.

Clergeau P. Oiseaux à risques en ville et en campagne: vers une gestion
intégrée des populations ? INRA. 1997. Versailles [500].
Google books.
 Le
hérisson (Erinaceus europaeus) fait aussi partie des animaux
qui se sont naturalisés en ville. Facilement apprivoisable, il est
souvent adopté comme animal de compagnie; d'ailleurs, il est même
importé aux États-Unis dans cet unique but. Ce charmant petit
insectivore se trouve être le réservoir de nombreuses zoonoses.
Il est constamment parasité par différentes espèces de
tiques, surtout I. ricinus et I. hexagonus, qui peuvent transmettre
B.burgdorferi sl, C. burnetii, Anaplasma phagocytophilum et
des arbovirus : le TBEV, Congo-Crimée, Tahyna, Bhanja... [281,459].
Le
hérisson (Erinaceus europaeus) fait aussi partie des animaux
qui se sont naturalisés en ville. Facilement apprivoisable, il est
souvent adopté comme animal de compagnie; d'ailleurs, il est même
importé aux États-Unis dans cet unique but. Ce charmant petit
insectivore se trouve être le réservoir de nombreuses zoonoses.
Il est constamment parasité par différentes espèces de
tiques, surtout I. ricinus et I. hexagonus, qui peuvent transmettre
B.burgdorferi sl, C. burnetii, Anaplasma phagocytophilum et
des arbovirus : le TBEV, Congo-Crimée, Tahyna, Bhanja... [281,459].
Ce hérisson se révèle lui-même être porteur
d'A. phagocytophilum et pourrait de ce fait constituer un risque pour
la Santé publique en zone urbaine [923].
Des tiques (essentiellement des Amblyomma spp.) sont fréquemment observées sur les reptiles d'importation tels que pythons ou varans, notamment en Pologne [937].
![]() Tableau
synoptique des Arboviroses transmises en France
Tableau
synoptique des Arboviroses transmises en France
![]() Flaviviridae
Flaviviridae
Complexe du TBEV
À la différence du TBEV, les autres virus appartenant au
complexe du TBEV ont la particularité d'occasionner des maladies du
bétail. Tous sont transmis ont pour vecteur principal I. ricinus.
Le virus Louping Ill (LIV) comprend 3 sous types ]britannique, irlandais
et espagnol, Spanish sheep encephalomyelitis (SSEV)].
Comme il est indiqué au paragraphe "Encéphalites européenne
à tiques", les études génomiques actuelles tendent
à montrer que TBEV et LIV appartiendraient en fait, à une seule
et même espèce [482]. Sa répartition géographique
s'étend bien au delà des Iles britanniques, il a déjà
été observé en Espagne et en Norvège.
Le Turkish sheep Tick-borne encephalitis virus (TSEV) a d'abord été
isolé en Turquie, il vient de l'être dans le nord de la Grèce
[Greek goat encephalitis virus (GGEV)] [496]. Pour l'auteur
de ce site, l'observation de cas d'encéphalite à tiques en Bulgarie
pourrait probablement lui être imputée si l'on tient compte de
leur proximité géographique avec les zones de prévalence.
Le LIV semble être transmis par un unique vecteur, I. ricinus,
il affecte essentiellement le mouton, chez lequel il provoque une encéphalite.
Les rongeurs constituent son réservoir, cependant il peut provoquer
de graves épidémies chez le lagopède d'Ecosse, avec une
mortalité proche de 80 %.
Chez l'homme, il semble qu'une grande part des infections demeure asymptomatique.
L'atteinte se traduit généralement par une encéphalite
légère, de type biphasique. Les rares cas cliniques concernent
essentiellement les bergers et le personnel de laboratoire. Après une
incubation de 4 à 7 jours, un syndrome grippal apparaît associé
à une photophobie. Les signes neurologiques et le rash cutané
sur l'abdomen sont plus tardifs, suivis par une guérison spontanée
sans séquelles.
La vaccination contre l'encéphalite à tiques confère
l'immunité croisée avec le LIV.
Le virus de la fièvre hémorragique d'Omsk (OHFV) a pour
réservoir amplificateur le rat musqué. L'introduction de ce
rongeur à des fins cynégétique est d'ailleurs la cause
de l'émergence de la maladie. Le virus est transmis par la morsure
de Dermacentor pictus, de D. marginatus et par contact direct
avec les carcasses de rats infectés.
Ce virus est prévalent surtout dans la partie occidentale de la Sibérie.
Après une incubation de 3 à 7 jours, les patients présentent
brutalement un syndrome grippal associant céphalées intenses,
 forte
fièvre, faciès vultueux et des saignements (nez et gencives).
Les lombalgies sont généralement très sévères.
Bradycardie, conjonctivite et adénopathies sont fréquemment
observées. Des pétéchies apparaissent à la pression
et aux points d'injection [504] .
forte
fièvre, faciès vultueux et des saignements (nez et gencives).
Les lombalgies sont généralement très sévères.
Bradycardie, conjonctivite et adénopathies sont fréquemment
observées. Des pétéchies apparaissent à la pression
et aux points d'injection [504] .
La mortalité peut atteindre 2,5%.
Il existe aussi une protection croisée avec le vaccin de l'encéphalite
à tiques.
Le virus de Kyanasur (KFDV) a pour réservoir les rongeurs.
Il est transmis principalement par la morsure d'Haemaphysalis spinigera
et d' Ixodes petauristae. Son réservoir comprend des vertébrés
variés (singes, rongeurs, chauves-souris et oiseaux)
On pensait que sa répartition géographique était limitée
au sud-ouest de l'Inde (état de Karnataka), mais il vient d'être
montré que le virus Nanjianyin sévissant dans la province chinoise
du Yunnan était en fait conspécifique [661] et que
le virus d'Alkhurma (ALKV) trouvé en Arabie Saoudite ne varie que par
8-9% de ses nucléotides. Selon une publication récente, l'ancêtre
commun de ces 3 souches remonterait vers 1942, soit une quinzaine d'années
avant l'identification du KFDV en Inde. La fièvre de Kyanasur serait
donc une maladie émergente probablement propagée par les oiseaux
[773].
Des épizooties fatales touchant les singes sauvages dans les régions
boisées du district de Shimoga, sont survenues en 1957, dans les suites
d'une déforestation intempestive pour créer des terres agricoles.
Puis la maladie a été transmise à l'homme au contact
des tiques. Le virus de la forêt de Kyasanur est aussi à l'origine
de nombreuses contaminations de laboratoire par des aérosols, tant
en Inde qu'aux États-Unis.
Les cas humains se manifestent après 3 à 8 jours d'incubation
par un intense syndrome grippal associé à un état de
prostration, des céphalées, des lymphadénopathies, une
conjonctivite. Les méningo-encéphalites sont relativement fréquentes.
Des manifestations hémorragiques sont possibles (nez, gorge, pétéchies).
Le taux de mortalité atteint les 10%.
Le traitement demeure exclusivement symptomatique.
Il existe un vaccin inactivé en 2 injections.

InVS. Virus de la forêt de Kyasanur Inde. 27 mars 2008.
Le virus d'Alkhurma (ALKV) est très proche du KFDV. Le réservoir
est constitué par les moutons et les chameaux. Le vecteur semblait
jusqu'alors être Haemaphysalis dromaderii, jusqu'à ce
que le virus soit isolé chez O. savignyi [442].
Cependant la contamination est possible par contact avec du sang ou du lait
contaminé.
 On
pensait que la répartion géographiqued'ALKV était limitée
à l'Arabie Saoudite, mais 2 patients ont été contaminés
en Égypte à la frontière avec le Soudan [920].
On
pensait que la répartion géographiqued'ALKV était limitée
à l'Arabie Saoudite, mais 2 patients ont été contaminés
en Égypte à la frontière avec le Soudan [920].
Après 3 à 8 jours d'incubation apparaît un intense syndrome
grippal associé à des douleurs rétro-orbitaires à
une anorexie et des vomissements. Un érythème, une encéphalite
et manifestations hémorragiques sont possibles. Le taux de mortalité
atteint les 25 % [921].
Le virus de Powassan (POWV) sévit en Amérique du Nord
et en Russie. Il est tranmis par la morsure des Haemaphysalis sp et
Ixodes sp (I. marxi et I. cookei).
Son réservoir est constitué par les petits mammifères
dont les marmottes.
Les infections humaines sont rares et le plus souvent asymptomatiques. Vingt
cas d'encéphalite ont été étudiés, ils
sont survenus après 3 à 7 jours d'incubation, ils comprenaient
un syndrome grippal avec une fièvre intense et une raideur de nuque.
Les signes neurologiques étaient présents dans tous les cas,
associés à des tremblement et des signes de focalisation [504].
Le taux de mortalité a été établi à 10%.
![]() Coltiviridae
Coltiviridae
Le virus de la fièvre du Colorado (CTFV) est transmis par Dermacentor
andersoni. Son réservoir est constitué par les petits mammifères.
Cent cas environ surviennent chaque année en Amérique du Nord,
posant le problème du diagnostic différentiel avec la fièvre
pourprée des Montagnes Rocheuses.
La maladie s'installe brutalement après une incubation moyenne de 2
à 4 jours (elle peut aller de 1 à 14 jours). Elle se traduit
par un intense syndrome grippal associé à des douleurs musculaires,
à une photophobie, des douleurs abdominales et vomissements ainsi qu'un
érythème. La fièvre fréquemment biphasique persiste
souvent plus de 3 semaines. Orchi-épididymite, pneumonie, péricardite,
myocardite, encéphalite ou manifestations hémorragiques sont
possibles.
Le diagnostic doit être soulevé chez toute personne présentant
un fièvre persistante au retour de la zone d'endémie [857].

Le risque transfusionnel est bien connu [502,563-565 ].
Voir la page Transplantation
et transfusion
![]()

Camicas JL. Tiques
et arbovirus (Revue bibliographique)
Chastel C, Camicas JL. Arbovirus
transmis par des Tiques et pathogènes pour l'homme ou pour les animaux
domestiques.
Goodman JL, Dennis DT, Sonenshine DE. Tickborne
diseases of Humans.
Charrel
RN et al.Tick-borne
virus diseases of human interest in Europe 2004 [508].
![]()
![]()
![]()
Malveillance et bio-terrorisme
 Bien
qu'il n'y ait que très peu d'information disponible, il existe des
éléments indiquant que la plupart des virus associés
aux encéphalites pourraient être utilisés à des
fins bio-terroriste, surtout par aérosolisation.
Bien
qu'il n'y ait que très peu d'information disponible, il existe des
éléments indiquant que la plupart des virus associés
aux encéphalites pourraient être utilisés à des
fins bio-terroriste, surtout par aérosolisation.
Toutefois la contamination des vecteurs est aussi une possibilité étudiée.
Les meilleurs candidats sont les alphavirus.
L'intérêt de l'utilisation de ces virus réside dans le
fait qu'il n'existe encore à ce jour, ni traitement ni vaccin [478].
![]()
L’encéphalite à tiques est en voie de dissémination en Europe occidentale, elle est présente en Alsace et en Lorraine. Quels sont les groupes à risque ?
Sur
la sérologie, mais les IgM ne persistent que quelques semaines
et il existe une réaction croisée avec tous les autres flavivirus.
Le
séjour en zone d’endémie justifie de proposer la vaccination
par Ticovac dans un centre de vaccination anti-amarile, si possible au
moins 9 mois avant le voyage et en période froide. Les mesures
d’évitement des morsures de tiques doivent cependant continuer
à être respectées.
1.
Les personnes exposées à la morsure de tiques.
2. Les consommateurs de lait cru et de fromage non pasteurisé.
Des cas familiaux sont décrits dans l’est de l’Europe.
![]()
![]()
![]()
Sur quoi repose le diagnostic biologique de l’encéphalite ?
![]() Cliquez
ici pour la réponse
Cliquez
ici pour la réponse
![]()
![]()
![]()
De futurs vacanciers envisagent de camper dans la forêt autrichienne l’été prochain, ils souhaitent se protéger contre l’encéphalite à tiques, que leur conseillez-vous ?
![]() Cliquez
ici pour la réponse
Cliquez
ici pour la réponse
Dernière mise à jour : le 19 03 2011
Remerciements à C. Chastel et à X. Haller