| Be
notified of page updates |
| powered by ChangeDetection |
La tularémie est une maladie infectieuse aiguë
rencontrée exclusivement dans l'hémisphère nord ; elle
est causée par un petit cocco bacille aérobie : Francisella
tularensis. Jusqu'à 70 cas sont signalés annuellement en France,
le plus souvent suite à un contact direct avec un lièvre. Le
principal réservoir de la maladie est en effet constitué par
les lagomorphes et les rongeurs, mais la bactérie est capable d'infecter
de bien d'autres espèces de vertébrés et d'invertébrés.
Dans trois quarts des cas, sa transmission s'effectue par contact direct avec
un animal infecté ; les autres surviennent à la suite d'un contact
avec un objet contaminé, ou après une piqûre d'arthropode
vecteur.
Après les dramatiques événements qui ont suivi le 11
septembre 2001, nul ne peut plus l'ignorer non plus, Francisella tularensis
constitue une arme biologique potentielle.
La maladie a été décrite pour la première
fois en 1911 par McCoy, sur des écureuils du comté de Tulare
(Californie). La bactérie devait être isolée l'année
suivante chez un patient souffrant d'une“deer flyfever”, sous le
nom de Bacterium tularense. En 1921, Francis décrit précisément
la maladie sous le nom de tularémie, mais différents synonymes
persistent: "rabbit fever", "hare fever", "deerfly
fever", "lemming fever", maladie de Ohara, maladie de Francis,
et encore bien d'autres…[214].
En 1924, Parker, Spencer et Francis isolent la bactérie chez Dermacentor
andersoni et démontrent le rôle des tiques dans la transmission
de la bactérie. Dès 1929, Parker montre qu'il existe une transmission
transovarienne de la bactérie, établissant ainsi le rôle
des tiques en tant que réservoir de la maladie.
En France, la répartition saisonnière des cas
de tularémie montre principalement un pic hivernal de novembre à
février. Cependant, la survenue des cas humains ne suit pas totalement
celle des cas animaux ; et le contact avec un lièvre n'est pas toujours
retrouvé.
La plupart des malades concernés appartient au groupe III des zoonoses
de l'OMS, ce qui suggère une possible transmission par morsure de tique.
Hypothèse renforcée par les travaux de Girard (1949), HH Mollaret
(1974) et de Raynaud (1991) [269].
Réservoir
Francisella tularensis a été isolée chez de très
nombreuses espèces animales : 190 espèces de mammifères,
25 d'oiseaux, 3 d'amphibiens et 88 espèces d'invertébrés.
En France, le réservoir serait
constitué à 95 % par le lièvre.
La sensibilité des animaux varie selon les espèces,
mais grosso modo, il est possible de distinguer 3 groupes [291]:

![]() Le
groupe 1 se compose des animaux les plus réceptifs à la
maladie : la plupart des espèces de rongeurs et des lagomorphes. Généralement
ces animaux sont atteints de formes septicémiques et meurent dans les
1 à 2 semaines. La maladie pourrait d'ailleurs constituer un des facteurs
de régulation de leurs populations. Les micromammifères représentent
la principale source d'infection des arthropodes, des autres animaux, de l'environnement
et de l'Homme.
Le
groupe 1 se compose des animaux les plus réceptifs à la
maladie : la plupart des espèces de rongeurs et des lagomorphes. Généralement
ces animaux sont atteints de formes septicémiques et meurent dans les
1 à 2 semaines. La maladie pourrait d'ailleurs constituer un des facteurs
de régulation de leurs populations. Les micromammifères représentent
la principale source d'infection des arthropodes, des autres animaux, de l'environnement
et de l'Homme.

![]() Le
groupe 2 est constitué par d'autres espèces rongeurs et
d'oiseaux, par les ovins, les bovins et les chiens. Ces animaux sont très
sensibles à la maladie, mais en meurent rarement. Aux États-Unis,
les moutons sont souvent contaminés par les tiques et représentent
une source de contamination humaine importante.
Le
groupe 2 est constitué par d'autres espèces rongeurs et
d'oiseaux, par les ovins, les bovins et les chiens. Ces animaux sont très
sensibles à la maladie, mais en meurent rarement. Aux États-Unis,
les moutons sont souvent contaminés par les tiques et représentent
une source de contamination humaine importante.

![]() Le
groupe 3 est constitué de carnivores qui nécessitent une
dose infectante élevée pour développer occasionnellement
une maladie patente. Le renard, le chat, le sanglier, les mustélidés,
consomment beaucoup de charognes, ils sont fréquemment porteurs de
la bactérie, mais ne semblent pas en souffrir ; de même que certains
oiseaux comme les faisans (qui consomment aussi des micro-mammifères)
[54]. Ces espèces sont considérées comme des
vecteurs passifs qui ne développent que rarement une forme clinique.
Le
groupe 3 est constitué de carnivores qui nécessitent une
dose infectante élevée pour développer occasionnellement
une maladie patente. Le renard, le chat, le sanglier, les mustélidés,
consomment beaucoup de charognes, ils sont fréquemment porteurs de
la bactérie, mais ne semblent pas en souffrir ; de même que certains
oiseaux comme les faisans (qui consomment aussi des micro-mammifères)
[54]. Ces espèces sont considérées comme des
vecteurs passifs qui ne développent que rarement une forme clinique.
Vecteurs et réservoir
Depuis de nombreux arthropodes se sont avérés porteurs de la
bactérie : des puces (qui l'excrètent dans leurs déjections),
poux, punaises, moustiques, taons (par transmission mécanique), araignées
et surtout des tiques qui ont la capacité de maintenir longtemps la
bactérie dans le milieu naturel [753].
Ces dernières jouent à la fois le rôle de vecteur et de
réservoir, puisque la transmission transovarienne de Francisella
tularensis est reconnue [55] ; même si elle ne porte
que sur un très faible pourcentage de tiques (C. Pérez-Eid ).
De nombreuses espèces de tiques sont ainsi capables d'entretenir l'infection
de façon pérenne : Amblyomma, Dermacentor, Haemaphysalis,
Ixodes, Ornithodoros. Le degré d'infestation serait 2
fois plus important chez les Dermacentor reticulatus [270],
certaines études donnent même un taux d'infestation de 2,6% contre
0,2% pour I. ricinus [691,692]. La bactérie est présente dans les fèces et le liquide coxal, mais surtout dans les glandes salivaires;
cette présence dans la salive, lui permet d'être injectée
rapidement lors de la morsure, sans nécessiter de temps de fixation
prolongé de la tique. Des co-infections ont été décrites,
notamment avec Borrelia burgdorferi sl [214], d'autres sont
possibles, notamment avec Coxiella burnetii [294].
dans les fèces et le liquide coxal, mais surtout dans les glandes salivaires;
cette présence dans la salive, lui permet d'être injectée
rapidement lors de la morsure, sans nécessiter de temps de fixation
prolongé de la tique. Des co-infections ont été décrites,
notamment avec Borrelia burgdorferi sl [214], d'autres sont
possibles, notamment avec Coxiella burnetii [294].
En raison de l'émergence de la tularémie en Espagne en 1997,
le Portugal surveille sa zone frontalière à risque. Il a organisé
une surveillance séro-épidémiologique des personnes à
risque, associée à une recherche d'ADN chez les tiques. Cette
surveillance objective la présence de la bactérie dans le pays,
elle montre en effet une prévalence de la maladie de 3,8% dans le groupe
étudié - dont un cas actif -. Le taux de prévalence chez
D. reticulatus est à 1,3% [437].
On peut légitimement s'interroger : Les animaux du
groupe1, très sensibles à la maladie, ne jouent-ils pas plutôt
un rôle d'hôtes amplificateurs que celui de réservoir de
la maladie?
Les animaux du groupe 2 et des tiques ne contribuent-ils pas à contaminer
davantage d'humains ?
Sources de contamination
L'environnement se fait contaminer essentiellement par les
déjections de rongeurs. Francisella tularensis est alors capable
de se maintenir durablement par des températures inférieures
à 0°C : jusqu'à 9 mois dans l'eau, la boue, sur les végétaux,
et 6 mois au moins dans les cadavres d'animaux morts de tularémie.
Au-delà de + 5°C, elle ne persiste que quelques jours. La présence
prolongée de la bactérie dans l'eau et la boue, pourrait être
liée à sa survie à l'intérieur de protozoaires
aquatiques, tels que les amibes [215].
Aucun cas de contamination interhumaine n'a pour l'instant été
décrit de façon formelle, mais ce risque est très probable.
On sait que la contamination par Francisella tularensis est possible,
suite au contact avec une plaie souillée, à l’exposition
à du sang ou à des produits biologiques contaminés.
En conséquence, le personnel soignant doit prendre toutes les précautions
d’hygiène nécessaires lors des soins aux patients atteints
de tularémie.
Modes de contamination
Comme les animaux, l'homme se contamine en pénétrant dans les
foyers naturels de tularémie.
Les modes de contamination diffèrent en fonction des portes d'entrées
de l'agent pathogène:
![]() La
voie de contamination la plus fréquente est cutanéo-muqueuse
: le germe pénètre à la faveur d'une brèche cutanée,
ou même en traversant directement la peau saine, comme Ohara l'a démontré
expérimentalement. Ce type de contamination se produit généralement
au contact de cadavres ou d'objets contaminés; il peut aussi survenir
suite à la griffure ou la morsure d'un animal porteur de l'agent infectieux.
Les chasseurs, et leurs femmes qui se chargent souvent du dépeçage,
y sont particulièrement exposés. Les muqueuses, conjonctivales
ou pharyngée, peuvent constituer une porte d'entrée à
l'occasion de projections ou d'une immersion dans un milieu contaminé.
La
voie de contamination la plus fréquente est cutanéo-muqueuse
: le germe pénètre à la faveur d'une brèche cutanée,
ou même en traversant directement la peau saine, comme Ohara l'a démontré
expérimentalement. Ce type de contamination se produit généralement
au contact de cadavres ou d'objets contaminés; il peut aussi survenir
suite à la griffure ou la morsure d'un animal porteur de l'agent infectieux.
Les chasseurs, et leurs femmes qui se chargent souvent du dépeçage,
y sont particulièrement exposés. Les muqueuses, conjonctivales
ou pharyngée, peuvent constituer une porte d'entrée à
l'occasion de projections ou d'une immersion dans un milieu contaminé.
![]() La
contamination digestive peut être la conséquence de la consommation
d'eau contaminée ou de viande insuffisamment cuite, des cas familiaux
peuvent alors être observés. Des cas ont également été
publiés suite à la consommation de lait ou de jus de pomme artisanal.
La
contamination digestive peut être la conséquence de la consommation
d'eau contaminée ou de viande insuffisamment cuite, des cas familiaux
peuvent alors être observés. Des cas ont également été
publiés suite à la consommation de lait ou de jus de pomme artisanal.
![]() La
contamination par inhalation d'aérosols est provoquée par la
manipulation d'animaux ou de produits contaminés (fourrure, laine,
litière, graines…). Elle peut aussi survenir à l'occasion
de travaux de jardinage sur un terrain contaminé par des animaux ou
des arthropodes (tonte de pelouse, débroussaillage). Deux cas de pneumopathie
tularémique ont été publiés à ce propos
en France en 2002 [216].
La
contamination par inhalation d'aérosols est provoquée par la
manipulation d'animaux ou de produits contaminés (fourrure, laine,
litière, graines…). Elle peut aussi survenir à l'occasion
de travaux de jardinage sur un terrain contaminé par des animaux ou
des arthropodes (tonte de pelouse, débroussaillage). Deux cas de pneumopathie
tularémique ont été publiés à ce propos
en France en 2002 [216].
Avec respectivement 534 et 507 cas, les épidémies espagnoles
de 1997 et 2007 présentaient tous les critères d'une contamination
par aérosols [584]. Onze chasseurs
sur 39 ont été infectés dans une baraque de chasse, par
l'inhation de gouttelettes contaminées disséminées dans
un périmètre de 5 mètres autour de lièvres éviscérés [829].
![]() La
contamination vectorielle indirecte ne peut plus être ignorée
non plus. Contamination mécanique, par effet seringue, occasionnée
par des insectes dérangés durant leur repas sur des animaux
porteurs (taons, stomoxes…).
La
contamination vectorielle indirecte ne peut plus être ignorée
non plus. Contamination mécanique, par effet seringue, occasionnée
par des insectes dérangés durant leur repas sur des animaux
porteurs (taons, stomoxes…).
Et surtout, contamination vectorielle vraie, occasionnée
par la morsure de tiques.
![]() Aux
États-Unis, les tiques sont reconnues comme étant le principal
facteur de transmission de la tularémie; dans certains États,
comme l'Arkansas, elles occasionnent plus de la moitié des cas humains.
Dans ce pays, la maladie présente deux pics d'activité, l'un
en rapport avec la chasse, l'autre avec la période d'activité
des tiques.
Aux
États-Unis, les tiques sont reconnues comme étant le principal
facteur de transmission de la tularémie; dans certains États,
comme l'Arkansas, elles occasionnent plus de la moitié des cas humains.
Dans ce pays, la maladie présente deux pics d'activité, l'un
en rapport avec la chasse, l'autre avec la période d'activité
des tiques.
![]() En
France, la période de prédilection de la maladie se situe en
automne-hiver, en même temps que la saison de chasse. Cependant des
cas estivaux affectent essentiellement les personnes exposées aux morsures
de tiques, et une demi douzaine de cas humains a été publiée
concernant essentiellement des Dermacentor sp. [217, 218]
.
En
France, la période de prédilection de la maladie se situe en
automne-hiver, en même temps que la saison de chasse. Cependant des
cas estivaux affectent essentiellement les personnes exposées aux morsures
de tiques, et une demi douzaine de cas humains a été publiée
concernant essentiellement des Dermacentor sp. [217, 218]
.
![]() Le
personnel de laboratoire, enfin, est exposé à un risque professionnel,
tant par inhalation, que par contact cutanéo-muqueux (manipulation
de cultures, blessure par matériel souillé, projection de substances
contaminées).
Le
personnel de laboratoire, enfin, est exposé à un risque professionnel,
tant par inhalation, que par contact cutanéo-muqueux (manipulation
de cultures, blessure par matériel souillé, projection de substances
contaminées).
Cas répertoriés
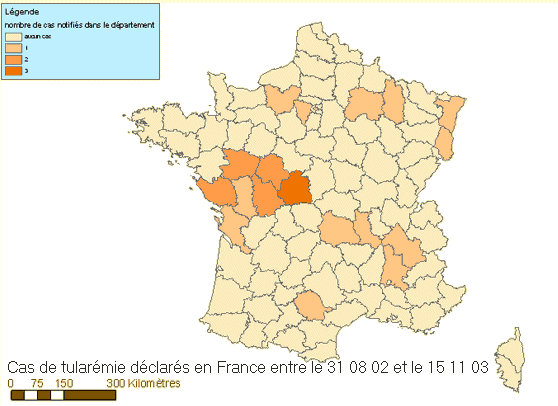 De
20 à 70 cas de tularémie sont déclarés chaque
année en France, 80 % des cas sont répertoriés dans les
foyers endémiques du nord-est et du centre du pays [56].
Des poussées épidémiques se produisent tous les 3 ou
4 ans, au moment où des pics de populations de micro-mammifères
sont enregistrés. La première épidémie été
observée en Lorraine (80 cas durant l'hiver 1949-1950). Si l'on fait
abstraction du personnel de laboratoire et des consommateurs de viande insuffisamment
cuite, les chasseurs et les personnes exposées au contact des animaux
représentent l'essentiel de la population à risque [218].
De
20 à 70 cas de tularémie sont déclarés chaque
année en France, 80 % des cas sont répertoriés dans les
foyers endémiques du nord-est et du centre du pays [56].
Des poussées épidémiques se produisent tous les 3 ou
4 ans, au moment où des pics de populations de micro-mammifères
sont enregistrés. La première épidémie été
observée en Lorraine (80 cas durant l'hiver 1949-1950). Si l'on fait
abstraction du personnel de laboratoire et des consommateurs de viande insuffisamment
cuite, les chasseurs et les personnes exposées au contact des animaux
représentent l'essentiel de la population à risque [218].
Trente cas par an, environ, ont été déclarés
en France de 2003 à 2005. Le diagnostic de la maladie a généralement
été posé assez tardivement, en raison de la rareté
de la maladie dans le pays [525].
Données épidémiologiques de la tularémie
(InVS
2003-2009)
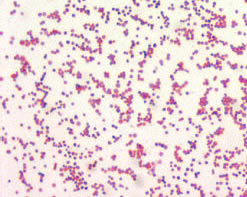 Francisella
tularensis est un petit cocco bacille aérobie non mobile, non sporulé,
Gram-négatif de 0,2 à 1,7 µm de longueur sur 0,2 à
0,7 µm de diamètre, qui pénètre dans les organismes
par inoculation, ingestion ou contamination. L'étude de l'ARNr 16S
montre que le genre Francisella appartient à la subdivision
gamma des Proteobacteria et qu'il est relativement proche des genres
Wolbachia, Coxiella et Legionella. [219, 220].
Francisella
tularensis est un petit cocco bacille aérobie non mobile, non sporulé,
Gram-négatif de 0,2 à 1,7 µm de longueur sur 0,2 à
0,7 µm de diamètre, qui pénètre dans les organismes
par inoculation, ingestion ou contamination. L'étude de l'ARNr 16S
montre que le genre Francisella appartient à la subdivision
gamma des Proteobacteria et qu'il est relativement proche des genres
Wolbachia, Coxiella et Legionella. [219, 220].
![]() Francisella
tularensis biovar tularensis (syn. nearctica ou type A de la classification
de Jellison) est retrouvé exclusivement en Amérique, c'est
le plus virulent. Toutefois, en 1998, curieusement, Gurycova rapporte l'isolement
de 17 souches à partir d'arthropodes collectés en Slovaquie.
Francisella
tularensis biovar tularensis (syn. nearctica ou type A de la classification
de Jellison) est retrouvé exclusivement en Amérique, c'est
le plus virulent. Toutefois, en 1998, curieusement, Gurycova rapporte l'isolement
de 17 souches à partir d'arthropodes collectés en Slovaquie.
![]() Francisella
tularensis biovar holarctica (syn. palearctica ou type B) est présent
en Amérique, en Europe et en Asie. Il est transmis par les rongeurs,
et occasionne des infections ulcéro-ganglionnaires plus ou moins
graves.
Francisella
tularensis biovar holarctica (syn. palearctica ou type B) est présent
en Amérique, en Europe et en Asie. Il est transmis par les rongeurs,
et occasionne des infections ulcéro-ganglionnaires plus ou moins
graves.
![]() Un
troisième biovar a été décrit plus récemment
: Francisella tularensis biovar mediasiatica
Un
troisième biovar a été décrit plus récemment
: Francisella tularensis biovar mediasiatica
Dix à 50 bactéries de type A suffisent à provoquer une infection cliniquement exprimée. La dose nécessaire pour provoquer une infection par Francisella tularensis biovar holarctica ou biovar mediasiatica est beaucoup plus importante, de l'ordre de 107 bactéries.
Immunologie
F. tularensis, comme Brucella ou Legionella, est une bactérie
à développement à la fois intra et extracellulaire. De
ce fait, l'immunité à médiation cellulaire tient une
place de choix, contrairement aux infections par bactéries extracellulaires
pour lesquelles le système de défense spécifique est
représenté par l'immunité humorale.
Physiopathologie
![]() F.
tularensis a développé des moyens pour contourner les mécanismes
d'immunité et faciliter sa survie intracellulaire en prévenant
la fusion phagolysosomale. On ignore encore le mécanisme précis
de cette stratégie, mais il semble lié à l'acquisition
de gènes autorisant l'expression de la protéine FPI (Francisella
pathogenicity island protein PdpD), ce qui évoque un système
de sécrétion VI (SST6 ou T6SS pour "type VI secretion system")
[940,941-943].
F.
tularensis a développé des moyens pour contourner les mécanismes
d'immunité et faciliter sa survie intracellulaire en prévenant
la fusion phagolysosomale. On ignore encore le mécanisme précis
de cette stratégie, mais il semble lié à l'acquisition
de gènes autorisant l'expression de la protéine FPI (Francisella
pathogenicity island protein PdpD), ce qui évoque un système
de sécrétion VI (SST6 ou T6SS pour "type VI secretion system")
[940,941-943].
L'échappement du phagosome lui permet de passer dans le cytoplasme,
à l'abri des mécanismes bactéricides cellulaires elle
se multiplie alors, jusqu'à ce que la mort cellulaire la dissémine
vers d'autres cellules.
Cette bactérie intracellulaire possède un tropisme d'organe
portant sur le derme et le système réticulo-histiocytaire. Après
pénétration cutanéo-muqueuse, elle se multiplie localement
avant de gagner les ganglions lymphatiques qui drainent la zone infectée.
Elle provoque alors des adénites qui peuvent s'abcéder. Le relai
ganglionnaire franchi, la bactérie passe dans le sang et essaime dans
la rate et le foie où elle se multiplie.
La tularémie possède une symptomatologie clinique très protéiforme. Avant l'ère de l'antibiothérapie, la mortalité des formes américaines atteignait 10 à 30 %, elle est maintenant nulle en cas de diagnostic précoce, et de 7% dans les formes à diagnostic tardif. Les formes européennes sont heureusement moins sévères, avec une mortalité inférieure à 1 % [221, 222, 223].
L'incubation dure généralement de 3 à 5 jours, mais elle peut varier en fonction des portes d'entrée. Brutalement, le patient présente une fièvre ondulante importante, voisinant les 40 °C, associée à des frissons, des céphalées, des nausées ou vomissements et un état de prostration. Puis il se plaint de faiblesse extrême, de frissons et de sueurs profuses.
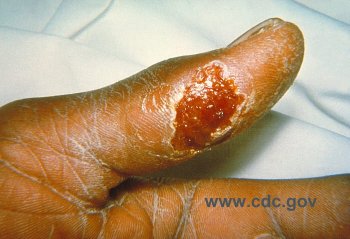 Un
à deux jours plus tard, les premiers symptômes, avec une papule
qui apparaît au point d'inoculation et va rapidement s'ulcérer.
L'ulcération est généralement isolée, sauf en
ce qui concerne la bouche et l'œil, mais un seul œil est habituellement
atteint. Les adénopathies satellites évoluent parallèlement:
d'abord douloureuses, elles s'indurent puis suppurent. Au cinquième
jour, le patient peut présenter des signes de pneumonie atypique ou
des signes neurologiques. Une éruption morbilliforme peut apparaître
à tout moment de l'évolution de la maladie. Non traitée,
la fièvre de la tularémie reste élevée pendant
3 à 4 semaines avant de baisser en lysis. L'infection confère
l'immunité.
Un
à deux jours plus tard, les premiers symptômes, avec une papule
qui apparaît au point d'inoculation et va rapidement s'ulcérer.
L'ulcération est généralement isolée, sauf en
ce qui concerne la bouche et l'œil, mais un seul œil est habituellement
atteint. Les adénopathies satellites évoluent parallèlement:
d'abord douloureuses, elles s'indurent puis suppurent. Au cinquième
jour, le patient peut présenter des signes de pneumonie atypique ou
des signes neurologiques. Une éruption morbilliforme peut apparaître
à tout moment de l'évolution de la maladie. Non traitée,
la fièvre de la tularémie reste élevée pendant
3 à 4 semaines avant de baisser en lysis. L'infection confère
l'immunité.
![]() La
revue bibliographique montre que certaines lésions cutanées
initiales peuvent aisément être confondues avec une infection
à Herpesvirus [530].
La
revue bibliographique montre que certaines lésions cutanées
initiales peuvent aisément être confondues avec une infection
à Herpesvirus [530].
Les formes cliniques dépendent étroitement
de la porte d'entrée du germe, par ordre de fréquence [224,
225] :
![]() Forme ulcéro-ganglionnaire (de Francis) dans 87 % des cas. Les adénopathies
sont le plus souvent axillaires, quelquefois épitrochléennes,
entourées d'une péri-adénite, associées à
une ulcération cutanée douloureuse et suintante de la main.
Le diagnostic est plus facile qu'en présence de lésions identiques
occasionnées par la morsure de tique. Les lésions peuvent alors
siéger au niveau du membre inférieur, du cou, du dos… l'adénopathie
se situant alors sur le territoire de drainage de la lésion. L'évolution
spontanée conduit à la fistulisation de l'adénopathie.
Les formes ganglionnaires pures sont dépourvues de lésion initiale
2 %. Signalons que 2 présentations ganglionnaires
inhabituelles de tularémie viennent d'être décrites en
mars 2008, après morsure de tique [524].
Forme ulcéro-ganglionnaire (de Francis) dans 87 % des cas. Les adénopathies
sont le plus souvent axillaires, quelquefois épitrochléennes,
entourées d'une péri-adénite, associées à
une ulcération cutanée douloureuse et suintante de la main.
Le diagnostic est plus facile qu'en présence de lésions identiques
occasionnées par la morsure de tique. Les lésions peuvent alors
siéger au niveau du membre inférieur, du cou, du dos… l'adénopathie
se situant alors sur le territoire de drainage de la lésion. L'évolution
spontanée conduit à la fistulisation de l'adénopathie.
Les formes ganglionnaires pures sont dépourvues de lésion initiale
2 %. Signalons que 2 présentations ganglionnaires
inhabituelles de tularémie viennent d'être décrites en
mars 2008, après morsure de tique [524].
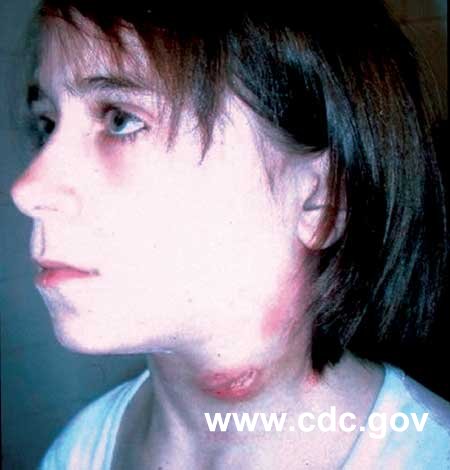
![]() Forme pharyngo- ou tonsillo-ganglionnaire (forme angineuse de Lavergne). La
clinique simule fréquemment une angine de Vincent ou une MNI. La contamination
est le plus souvent alimentaire, les enfants sont le plus souvent touchés
et les cas familiaux sont possibles.
Forme pharyngo- ou tonsillo-ganglionnaire (forme angineuse de Lavergne). La
clinique simule fréquemment une angine de Vincent ou une MNI. La contamination
est le plus souvent alimentaire, les enfants sont le plus souvent touchés
et les cas familiaux sont possibles.
![]() Forme oculo-ganglionnaire (syndrome oculo-ganglionnaire de Parinaud) dans
3 % des cas [814]. Elles entraînent une conjonctivite purulente unilatérale
très douloureuse ; accompagnée par des adénopathies
prétragiennes et sous-maxillaires. Un syndrome de Parinaud peut également
être rencontré lors de bartonelloses,
pathologies potentiellement transmises par les tiques.
Forme oculo-ganglionnaire (syndrome oculo-ganglionnaire de Parinaud) dans
3 % des cas [814]. Elles entraînent une conjonctivite purulente unilatérale
très douloureuse ; accompagnée par des adénopathies
prétragiennes et sous-maxillaires. Un syndrome de Parinaud peut également
être rencontré lors de bartonelloses,
pathologies potentiellement transmises par les tiques.
![]() Forme fébrile pure ou pseudo-typhoïde dans 8 % des cas avec fièvre
et douleurs abdominales. Des formes rapidement mortelles sont rapportées,
et les localisations pulmonaires secondaires sont fréquentes.
Forme fébrile pure ou pseudo-typhoïde dans 8 % des cas avec fièvre
et douleurs abdominales. Des formes rapidement mortelles sont rapportées,
et les localisations pulmonaires secondaires sont fréquentes.
![]() Forme respiratoire (ou maladie des trieurs de laine, exceptionnelle en France).
Elle est consécutive à une dissémination par voie hématogène,
ou par inhalation de particules infectées. L'auscultation pulmonaire
est généralement pauvre et la radiographie pulmonaire montre
une pneumonie atypique. Le pronostic vital peut être menacé par
la survenue d'un syndrome de détresse respiratoire aiguë.
Forme respiratoire (ou maladie des trieurs de laine, exceptionnelle en France).
Elle est consécutive à une dissémination par voie hématogène,
ou par inhalation de particules infectées. L'auscultation pulmonaire
est généralement pauvre et la radiographie pulmonaire montre
une pneumonie atypique. Le pronostic vital peut être menacé par
la survenue d'un syndrome de détresse respiratoire aiguë.
![]() Manifestations particulières. Chez l'enfant, fièvre, pharyngite,
hépatomégalie et signes généraux sont plus fréquents
que chez l'adulte.
Manifestations particulières. Chez l'enfant, fièvre, pharyngite,
hépatomégalie et signes généraux sont plus fréquents
que chez l'adulte.
![]() Intensité. Les formes de gravité exceptionnelle sont liées
à la dissémination septicémique de la bactérie.
De nombreuses atteintes sont possibles : hépatite, néphrite,
péricardite, méningite et méningo-encéphalite,
syndrome de Guillain Barré, ostéomyélite, érythème
noueux… Les comorbidités et retards de diagnostic constituent
des facteurs aggravants. Des formes inapparentes sont régulièrement
découvertes lors d'enquêtes séro-épidémiologiques
dans les zones épidémiques.
Intensité. Les formes de gravité exceptionnelle sont liées
à la dissémination septicémique de la bactérie.
De nombreuses atteintes sont possibles : hépatite, néphrite,
péricardite, méningite et méningo-encéphalite,
syndrome de Guillain Barré, ostéomyélite, érythème
noueux… Les comorbidités et retards de diagnostic constituent
des facteurs aggravants. Des formes inapparentes sont régulièrement
découvertes lors d'enquêtes séro-épidémiologiques
dans les zones épidémiques.
La notion de sujet à risque et la clinique sont souvent
évocatrices de la maladie. En l'absence de cette notion, les formes
pulmonaires ou pseudo-typhiques sont d'un diagnostic difficile. L'hémogramme
est le plus souvent normal, sauf dans les formes graves où une leucocytose
avec polynucléose neutrophile peut être observée. La vitesse
de sédimentation est habituellement normale, les enzymes hépatiques
et CPK légèrement augmentés, pouvant égarer le
diagnostic vers "les nouvelles rickettsioses".
L'isolement du germe à partir du sang, des exsudats, des suppurations
ganglionnaires, voire des expectorations permet le diagnostic positif. Cependant
le diagnostic bactériologique reste délicat en raison des exigences
de croissance du germe, le clinicien devra donc indiquer expressément
qu'il recherche une tularémie.
La sérologie (macroagglutination en tubes) se positive après
le dixième jour, le taux croissant des anticorps confirme le diagnostic.
Il est connu de longue date qu'il existe des réactions croisées
faibles entre Francisella, Brucella et à un moindre degré
Yersinia enterocolitica. Une évaluation des réactions
croisées est donc hautement souhaitable.
Il faut tenir compte du délai d'appartition des anticorps et inciter
à réaliser des sérologies tardives; les sérologies
faiblement positives à Francisella, Brucella ou Yersinia
doivent aussi inciter à pratiquer des sérologies complémentaires.Le
Western Blot peut mettre en évidence les protéines 17kDa et
43 kDa qui sont spécifiques de F. tularensis.
Le diagnostic par PCR est sensible et spécifique (gène codant
la protéine de 17kDa).
L'intradermo-réaction à la tularine serait également
assez spécifique, se positivant dès le cinquième jour,
mais la tularine a été supprimée de la pharmacopée
française.
L'infection confère une immunité durable, il existe cependant
des cas de réinfection authentifiés [57].
Définition de cas :
Cas certain
- tableau clinique évocateur ET
- sérologie positive avec un titre supérieur ou égal
à 50, OU
- isolement de F. tularensis à partir de prélèvements
cliniques.
Cas probable
- tableau clinique évocateur ET
- sérologie avec un titre compris entre 20 et 50, OU
- avec un lien épidémiologique avec un cas confirmé
Centre National de Référence
pour Francisella
Pour être efficace au stade suppuratif, le traitement
doit faire appel à l'association doxycycline (ou minocycline) et aminoside
(gentamycine, kanamycine). L'utilisation isolée de bactériostatiques
(cyclines, phénicolés, ou macrolides qui connaissent de nombreuses
bactéries résistantes) expose à de multiples rechutes.
L'association à la streptomycine (0.5g IM toutes les 12 heures) est
possible ou bien streptomycine seule à 1 ou 2 g/jour chez l'adulte
(60 mg/kg/jour chez l'enfant) pendant 20 jours [58]. Le traitement
prolongé par quinolones pendant 15 jours a donné d'excellents
résultats (ciprofloxacine). L'Agence française de sécurité
sanitaire des produits de santé préconise la ciprofloxacine,
l'ofloxacine ou la lévofloxacine, comme traitement de première
intention (voir la Fiche
thérapeutique n° 4 Tularémie).
NB Les céphalosporines de troisième génération,
actives in vitro, ne sont pas efficaces in vivo.
Le traitement local des ulcérations par pansement humide, le drainage
chirurgical et antibiothérapie locale sont quelquefois nécessaires
lors des prises en charge tardives.
Pour les atteintes oculaires, si les compresses chaudes et les lunettes noires
ne suffisent pas, le soulagement peut être obtenu par homatropine collyre
à 1% à raison de 6 instillations par jour. Les céphalées
cèdent bien à la codéine [59].
L'étendue du réservoir est telle qu'il est difficile d'envisager une prévention très efficace, néanmoins plusieurs mesures sont de nature à limiter le risque :
- Le dépistage des épizooties chez le lièvre et les rongeurs sauvages.
- L'importation de rongeurs ou lagomorphes, morts ou vifs, est soumise à autorisation des Directions des Services Vétérinaires. Une épidémie s'est notamment déclenchée aux États-Unis en 2002 parmi des chiens de prairie commercialisés en animalerie [226].
- Les élevages et les locaux agricoles doivent être protégés des intrusions de rongeurs sauvages.
- Toute suspicion de tularémie doit être déclarée aux services vétérinaires.
- Pour ce qui est des soins aux malades, il est préférable de n'utiliser que du matériel à usage unique. Le reste du matériel doit être très rigoureusement désinfecté avant de pouvoir être réemployé.
- Une extrême prudence s'impose pour manipuler les tissus infectés, le pouvoir contaminant de ce germe est tel que son isolement ne doit être effectué que par un personnel spécialisé dans un laboratoire équipé de hottes aspirantes (niveau de confinement 3)[59].
À titre individuel :
- La manipulation des animaux ne doit jamais se faire sans gants.
- Le gibier, oiseau ou mammifère, ne doit être consommé que bien cuit.
- Il faut rappeler que même les végétaux et l'eau peuvent être contaminants [60].
- Les habituelles mesures de protection contre les morsures de tiques sont indispensables.
- Un vaccin vivant atténué existe aux États-Unis, mais
son usage est actuellement suspendu pour évaluation. L'installation
de l'immunisation prend 2 semaines, ce qui rend son emploi illusoire chez
les personnes ayant été exposées au risque [222].

Le 1er février 2007, les laboratoires EpiVax ont annoncé qu'ils allaient développer un candidat vaccin (TuliVax). Ce vaccin vient de faire ses preuves chez la souris (Source accédée le 25 02 07 : http://www.riedc.com/files/February2007_EpiVax_PR.pdf ).
La déclaration obligatoire
(DO) de la tularémie était supprimée depuis 1986.
Cependant, le décret n° 2002-1089 du 7 août 2002, relatif
au signalement et à la notification obligatoire des cas humains de
tularémie paru au Journal officiel du 11 août 2002, a remis en
place le signalement en urgence : " Tout docteur en médecine
ou tout biologiste responsable d'un laboratoire ayant connaissance d'un cas,
doit le signaler sans délai au médecin inspecteur de santé
publique (MISP) de la DDASS concernée, par téléphone
ou par télécopie (ou tout autre moyen jugé pertinent).
Lors du signalement, le MISP veillera à rechercher auprès du
déclarant s'il existe des indices pouvant faire évoquer une
origine malveillante à l'infection. Dans ce cas, il est nécessaire
de saisir le procureur de la République [227]".
 L'arrêté
du 10 février 2003, paru au Journal Officiel du 25 février,
relatif à la déclaration obligatoire des maladies infectieuses
(DO), précise le modèle de fiche sur laquelle la notification
doit être effectuée.
L'arrêté
du 10 février 2003, paru au Journal Officiel du 25 février,
relatif à la déclaration obligatoire des maladies infectieuses
(DO), précise le modèle de fiche sur laquelle la notification
doit être effectuée.
Documents disponibles en ligne :
Fiche de DO imprimable
Surveillance
de la tularémie
ainsi que Cas
groupés de tularémie, Vendée 2004.

Pour plus d'information, on se rapportera au
Cahier de formation Biologie Médicale n° 40 de Bioforma. Chapitre
I. Francisella
tularensis et tularémie. J Vaissaire & A Le Coustumier [494].
WHO
Guidelines on Tularaemia
 La
tularémie, sous toutes ses formes cliniques, est inscrite au tableau
des maladies professionnelles sous le numéro 68 pour le régime
général, et sous le numéro 7 pour le régime
agricole. Le groupe à risque est constitué par les chasseurs,
les gardes-chasse, les forestiers, les agriculteurs, ainsi que les bouchers,
cuisiniers, employés de laboratoire.
La
tularémie, sous toutes ses formes cliniques, est inscrite au tableau
des maladies professionnelles sous le numéro 68 pour le régime
général, et sous le numéro 7 pour le régime
agricole. Le groupe à risque est constitué par les chasseurs,
les gardes-chasse, les forestiers, les agriculteurs, ainsi que les bouchers,
cuisiniers, employés de laboratoire.
![]()
![]()
![]()
Malveillance et bio-terrorisme [222]
![]() Retour
vers Fièvre Q
Retour
vers Fièvre Q
 Après
l'utilisation du gaz sarin le 20 mars 1995 à Tokyo, les attentats du
11 septembre 2001 à New-York, puis l'envoi postal de spores militarisées
de Bacillus anthracis aux États-Unis, le Monde a pleinement
pris conscience du risque que présente le terrorisme NRBC.
Après
l'utilisation du gaz sarin le 20 mars 1995 à Tokyo, les attentats du
11 septembre 2001 à New-York, puis l'envoi postal de spores militarisées
de Bacillus anthracis aux États-Unis, le Monde a pleinement
pris conscience du risque que présente le terrorisme NRBC.
De nombreuses souches bactériennes ou virales pourraient être
utilisées en tant qu'armes biologiques… F. tularensis,
particulièrement le biovar tularensis, représente un
des agents biologiques les plus "intéressants" à militariser
[944] : en raison de son aérosolisation possible, de son
incubation brève et de sa mortalité élevée. Le
danger présenté par son utilisation n'est sans aucun doute pas
de nature à intimider les kamikazes [228, 229]….
 Son emploi
pourrait être envisagé aussi pour contaminer les réseaux
d'alimentation d'eau et les aliments. Mais la dissémination par aérosol
est le scénario le plus probable, car elle permet d'obtenir un maximum
de victimes. Selon un rapport de l'OMS en 1969, 50 kg de F tularensis
dispersés sur une zone urbaine de 5 millions d'habitants pourraient
entraîner 250 000 cas, dont 19 000 morts. On suspecte d'ailleurs
les soviétiques d'avoir utilisé ce procédé en
1942 durant la bataille de Stalingrad (30 000 soldats Allemands ont été
contaminés, avant que ne se déclenche une épidémie
de plus de 100 000 cas dans la population et les troupes soviétiques).
Une attaque bio-terroriste n'est envisageable qu'en milieu urbain, là
où la population est suffisamment importante ; les souches militarisées
ont une incubation courte de 3 à 5 jours et le diagnostic de la maladie,
hors du contexte d'exposition, est particulièrement difficile. L'effondrement
de l''Union soviétique a entraîné le décret de
1992 où Boris Yeltsin a aboli la recherche et le développement
en matière d’armes biologiques offensives. l’existence misérable
de l’écrasante majorité
Son emploi
pourrait être envisagé aussi pour contaminer les réseaux
d'alimentation d'eau et les aliments. Mais la dissémination par aérosol
est le scénario le plus probable, car elle permet d'obtenir un maximum
de victimes. Selon un rapport de l'OMS en 1969, 50 kg de F tularensis
dispersés sur une zone urbaine de 5 millions d'habitants pourraient
entraîner 250 000 cas, dont 19 000 morts. On suspecte d'ailleurs
les soviétiques d'avoir utilisé ce procédé en
1942 durant la bataille de Stalingrad (30 000 soldats Allemands ont été
contaminés, avant que ne se déclenche une épidémie
de plus de 100 000 cas dans la population et les troupes soviétiques).
Une attaque bio-terroriste n'est envisageable qu'en milieu urbain, là
où la population est suffisamment importante ; les souches militarisées
ont une incubation courte de 3 à 5 jours et le diagnostic de la maladie,
hors du contexte d'exposition, est particulièrement difficile. L'effondrement
de l''Union soviétique a entraîné le décret de
1992 où Boris Yeltsin a aboli la recherche et le développement
en matière d’armes biologiques offensives. l’existence misérable
de l’écrasante majorité
des chercheurs pourrait avoir favorisé une fuite des technologies et
du matériel issus de l’ancien programme [833]
Cette menace ne doit donc pas être sous-estimée, même si F. tularensis n'était pas initialement concernée par le plan Biotox. Comme l'indique l'InVS, les mesures de protection de la population civile doivent être renforcées. À cette fin les médecins doivent connaître les scénarios pouvant faire évoquer une malveillance ou une attaque bioterroriste par Francisella tularensis en France, car comme l'indique K. Alibek " La première chose à faire pour trouver le moyen de nous préserver, est de comprendre que ce sont les armes bactériologiques, et comment elles fonctionnent " [229, 230].

Les risques NRBC, Savoir pour agir recense les différents risques
connus dans les domaines nucléaire, radiologique, biologique et chimique.
Il aborde chaque thème d'une façon globale et préconise
les techniques particulières dans la prise en charge et le traitement
de chaque risque.
Pour en savoir plus ...
Arbre décisionnel proposé par l'InVS
Centre National de Référence pour Francisella
AFSSAPS
Biotox/Piratox dernière mise à jour le11 04 05
Parmi ces affirmations, quelles sont celles qui sont exactes ?
Réponse :
![]()
![]()
![]()
Quelles sont les formes cliniques de la tularémie ?
![]() Cliquez
ici pour la réponse
Cliquez
ici pour la réponse
Les formes cliniques sont fonction de la porte d’entrée du germe :
1. ulcéro-ganglionnaire dans 87 % des cas.
2. pseudo-typhoïde dans 8 % des cas avec fièvre et douleurs abdominales.
3. oculo-ganglionnaire dans 3 % des cas avec des adénopathies prétragiennes.
4. ganglionnaire pure avec des adénopathies régionales sans lésion initiale 2 %.
1.
La manipulation des animaux ne doit jamais se faire sans gants.
2. Le gibier, oiseau ou mammifère, ne doit être consommé
que bien cuit.
3. Même les végétaux et l’eau peuvent être
contaminants.
4. Les mesures de protection contre les morsures de tiques sont indispensables.Il
s’effectue en recherchant des hématozoaires intra-érythrocytaires
non pigmentés
sur
frottis sanguin.
![]()
![]()
![]()
Quelles sont les mesures de prophylaxie ?
![]() Cliquez
ici pour la réponse
Cliquez
ici pour la réponse
Dernière mise à jour : le 16 01 2011
Remerciements à C. Tram et à A. Le Coustumier
