 Page
d'accueil
Page
d'accueil | Be
notified of page updates |
| powered by ChangeDetection |
La fièvre boutonneuse est une rickettsiose, due
à Rickettsia conorii.
Comme son nom l’indique, elle sévit sur le pourtour méditerranéen,
ainsi que dans une grande partie de l’Afrique et en Asie, de la Turquie à
la Birmanie. Sa large répartition géographique explique la diversité
des noms qui lui sont donnés: typhus à tiques sud-africain,
fièvre indienne à tiques, fièvre de Marseille, fièvre
d'Astrakhan, fièvre à tiques sud-africaine…
Elle explique aussi que plusieurs souches de Rickettsia ont été
proposées comme de nouvelles espèces. Ces souches sont maintenant
reconnues comme appartenant au “complexe de R. conorii” :
R. conorii indica (Indian tick typhus), R. conorii israelensis
(Israeli spotted fever), R. conorii caspia (Astrakhan fever).
Compte tenu de l'étendue de sa répartition géographique
et de l'existence de 4 sous-espèces, l'agent pathogène possède
plusieurs vecteurs : sur tous les continents le plus fréquemment
rencontré appartient au genre Rhipicephalus, R. sanguineus
en Europe. Mais selon les régions du Monde, il existe d'autres vecteurs
: en Afrique il peut s'agir d'une Haemaphysalis, en Asie d'une Haemaphysalis
ou de Boophilus.
Considérée longtemps comme bénigne, on sait maintenant
que la FBM est en réalité au moins aussi grave que la Fièvre
des Montagnes Rocheuses; le taux de mortalité atteignait 32,3 %
au Portugal en 1997.
 En
France cette pathologie se manifeste durant la période d’activité
des tiques, d’avril à octobre. Elle est due à Rickettsia
conorii subsp conorii qui est généralement transmise
à l’homme par la tique brune du chien, Rhipicephalus sanguineus.
En
France cette pathologie se manifeste durant la période d’activité
des tiques, d’avril à octobre. Elle est due à Rickettsia
conorii subsp conorii qui est généralement transmise
à l’homme par la tique brune du chien, Rhipicephalus sanguineus.
Cette tique est à la fois le vecteur et le réservoir de la
maladie, compte-tenu de la transmission trans-stadiale et transovarienne de
la rickettsie [476]. Le faible taux d'infection
des tiques, de l'ordre de 1 %, s'expliquerait par la stratégie
de survie des Rickettsia. Ces bactéries entreraient en dormance
afin d'économiser leur peu d'énergie, elles ne seraient réactivées
que par le réchauffement et le gorgement de la tique [717].
Le cycle épidémiologique domestique centré sur le chien et sa tique est le principal mode de contamination de l’homme. Selon l'étude menée par D. Raoult entre 1982 et 1987, la présence d'un chien est retrouvée dans 82 % des cas [476]. Cependant un cycle épidémiologique sauvage le réalimente occasionnellement, par le biais de diverses tiques qui parasitent indifféremment les animaux réservoirs sauvages (petits mammifères) et domestiques (bovins, caprins, ovins, chiens, chats…). Une partie de ces tiques est susceptible de mordre l’homme (Rhipicephalus turicanus, Dermacentor marginatus, Ixodes ventalloi et Hæmaphysalis hispanica) et de lui transmettre Rickettsia conorii [68,813]. En France, il semblerait que le Lapin de garenne (Oryctolagus cuniculus) pourrait être le réservoir de la maladie; à l'appui de cette hypothèse la chute d'incidence concomitante avec l'épidémie de myxomatose de 1952 [600].
La fièvre boutonneuse est une maladie saisonnière, survenant essentiellement de mai à octobre : Distribution saisonnière des cas de Tibola [331]. Le pic d'incidence de la maladie de juillet à septembre, est la conséquence de l'activité des formes immatures. Il est communément admis que le vecteur doit rester fixé au moins 20 heures pour transmettre la maladie. Or, la morsure de ces tiques minuscules passe souvent inaperçue.
L'âge moyen des patients se situe à 43 ans,
avec une légère prédominance masculine (sex-ratio
1,35). La mortalité atteint 1 à 3 % des cas, mais elle semble
varier selon sensiblement les régions et années [600].
Elle affecte principalement les patients âgés de plus
de 60 ans ou immunodéprimés [526]. Des séquelles
persistent dans 2 % des cas, neurologiques, hématologiques ou cardiaques
[476]. Curieusement la maladie semble demeurer bénigne pour
les enfants.
Les hospitaliers estiment l'incidence de la FBM à 15/100 000 habitants,
cependant un malade sur 3 - au grand maximum - serait hospitalisé.
Selon P. Parola, elle serait de l'ordre de 48/100.000 dans le sud-est, avec
un pic très net d'incidence en août. Les complications seraient
donc vraisemblablement aussi surévaluées...
Cependant ces données doivent être considérées
avec prudence, car la sévérité varie selon les lieux
et les années. À Salamanque (Espagne) les cas sévères
représentaient 19 % des cas en 1983, contre 3.7% en 1981) et 4.34%
en 1982. En 1997 à Beja (Sud du Portugal), le taux de mortalité
des FBM hospitalisées atteignait 32,3 %, contre moins de 15 %
les années précédentes [600].
L'hypothèse que l'augmentation des maladies vectorisées par
R. sanguineus est liée au réchauffement climatique est soulevée.
À l'appui l'augmentation de l'incidence en Sardaigne en 2007 et les
167 cas survenus à Oran de 2006 à 2007 (49% hospitalisés
avec une forme sevère, 7% formes malignes avec défaillance multiviscérale
et 3% de mortalité dont 55% par défaillance multiviscérale)
[618].
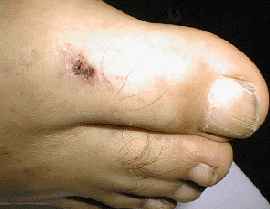 L’incubation
dure en moyenne une semaine, puis brutalement la fièvre apparaît,
souvent au-delà de 39°C, elle est associée à une asthénie,
à des céphalées intenses rebelles aux antalgiques, parfois
à une confusion mentale, à un délire ou à une
injection conjonctivale. Dans 3/4 des cas, une tache noire est retrouvée
simultanément . Elle siège au point de morsure, qui se situe
le plus souvent sur les membres inférieurs, le pli de l'aine ou le
creux axillaire. Cette escarre d’inoculation mesure environ 3 à 5 mm,
elle est centrée sur un halo inflammatoire de 2 à 3 cm de diamètre.
Elle est généralement unique, accompagnée d’une adénopathie
satellite. Toutefois, des observations réalisées lors de périodes
chaudes montrent que les Rh. sanguineus modifient leur stratégie
de conquête en devenant chasseurs et en s'attaquant plus volontiers
à l'homme. Des escarres multiples sont donc possibles [623].
L’incubation
dure en moyenne une semaine, puis brutalement la fièvre apparaît,
souvent au-delà de 39°C, elle est associée à une asthénie,
à des céphalées intenses rebelles aux antalgiques, parfois
à une confusion mentale, à un délire ou à une
injection conjonctivale. Dans 3/4 des cas, une tache noire est retrouvée
simultanément . Elle siège au point de morsure, qui se situe
le plus souvent sur les membres inférieurs, le pli de l'aine ou le
creux axillaire. Cette escarre d’inoculation mesure environ 3 à 5 mm,
elle est centrée sur un halo inflammatoire de 2 à 3 cm de diamètre.
Elle est généralement unique, accompagnée d’une adénopathie
satellite. Toutefois, des observations réalisées lors de périodes
chaudes montrent que les Rh. sanguineus modifient leur stratégie
de conquête en devenant chasseurs et en s'attaquant plus volontiers
à l'homme. Des escarres multiples sont donc possibles [623].
 Fréquemment
vers le quatrième jour, une éruption maculo-papuleuse débute
par le tronc avant de s’étendre, en 72 heures, aux quatre membres,
aux paumes des mains et à la plante des pieds, en respectant la face.
La fièvre se maintient jusqu’à la deuxième semaine de
maladie. Les éléments cutanés prennent un aspect cuivré
avant de disparaître progressivement, laissant une pigmentation transitoire.
Une atteinte rénale ou pulmonaire survient quelquefois, et très
rarement une forme neurologique. De rares décès surviennent,
chez des patients âgés ou débilités (diabète,
alcoolisme, tabagisme, immunodépression, déficit en G6PD).
Fréquemment
vers le quatrième jour, une éruption maculo-papuleuse débute
par le tronc avant de s’étendre, en 72 heures, aux quatre membres,
aux paumes des mains et à la plante des pieds, en respectant la face.
La fièvre se maintient jusqu’à la deuxième semaine de
maladie. Les éléments cutanés prennent un aspect cuivré
avant de disparaître progressivement, laissant une pigmentation transitoire.
Une atteinte rénale ou pulmonaire survient quelquefois, et très
rarement une forme neurologique. De rares décès surviennent,
chez des patients âgés ou débilités (diabète,
alcoolisme, tabagisme, immunodépression, déficit en G6PD).
![]() Formes
cliniques
Formes
cliniques
La séméiologie de la fièvre boutonneuse est en fait plus
variable qu’elle ne le paraît. Dans certains cas, l’atteinte clinique
peut se limiter à une pneumopathie aiguë montrant des opacités
hilifuges à la radiographie pulmonaire. Dans d’autres elle se manifeste
par une encéphalopathie ou une pleuropéricardite primitive.
De rares conjonctivites unilatérales peuvent signer une contamination
oculaire.
En l’absence d’exanthème et de tache noire escarotique, seuls les examens
biologiques demandés systématiquement peuvent contribuer à
poser le diagnostic.
Jusqu’alors Rickettsia conorii était supposée
être le seul agent pathogène responsable des fièvres à
tiques survenant dans les régions ouest du pourtour méditerranéen.
Trois cas de fièvre israélienne à tiques viennent d’être
reconnus parmi le millier de cas annuels de fièvre méditerranéenne
survenant au Portugal. Le diagnostic a été porté grâce
à l’étude des séquences des gènes codant la citrate
synthétase, la protéine rOmpA et la partie 16 S de l’ARN ribosomal
qui a mis en évidence les 100% de similitudes avec les gènes
homologues de la Rickettsia responsable de la fièvre israélienne
à tiques.
Cette Rickettsia a été isolée en Israël en
1974, chez des tiques et des humains, et semblait confinée à
ce seul pays [68]. La découverte portugaise démontre
que la distribution géographique de cette Rickettsia est plus
large qu’elle n’était supposée, et qu’elle s’étend à
la péninsule ibérique.
Aucun des 3 patients ne présentait de tache noire. Cette absence est
caractéristique de la fièvre israélienne, de même
que la symptomatologie particulièrement atypique qui peut occasionner
des retards à la mise en œuvre du traitement. Deux des patients en
sont même décédés.
![]() Ces
premières impressions se trouvent hélas confirmées avec
la publication de 2 articles. Celui de M. Weinberger (mai 2008) relate
le décès d'un israëlien de 51 ans et montre bien comment
tout retard de diagnostic peut être fatal. Celui de N Boilat (décembre
2008) rapporte le décès d'un homme de 63 ans après une
croisière en Méditerrannée, il aurait probablement été
contaminé en Lybie où la bactérie n'a pas encore été
identifiée.
Ces
premières impressions se trouvent hélas confirmées avec
la publication de 2 articles. Celui de M. Weinberger (mai 2008) relate
le décès d'un israëlien de 51 ans et montre bien comment
tout retard de diagnostic peut être fatal. Celui de N Boilat (décembre
2008) rapporte le décès d'un homme de 63 ans après une
croisière en Méditerrannée, il aurait probablement été
contaminé en Lybie où la bactérie n'a pas encore été
identifiée.
En conséquence, il est indispensable d'envisager
cette recherche systématiquement chez tout patient revenant d'une zone
s'endémie [520,634].
![]() Fièvre
à tiques à R. massiliae
Fièvre
à tiques à R. massiliae
Rickettsia massiliae a été isolée
en 1985 et identifiée en 2005. Sa pathogénicité a donc
été longtemps méconnue, peut-être simplement parce
que la présentation clinique de l'infection ne se distingue en rien
de la FBM classique.
Toutefois il est très important de signaler que cette bactérie
présente la particularité de résister naturellement à
la rifampicine.
En conséquence, dans les zones où elle est endémique,
le traitement de première intention doit absolument éviter ce
traitement au profit de la doxycycline [621,622].
 Ce
sont les arguments épidémiologiques et cliniques qui permettent
d’engager un traitement, qui ne doit d’ailleurs pas être différé.
Mais le diagnostic ne peut pas être affirmé sans la confirmation
biologique. Les prélèvements adressés au laboratoires
doivent toujours être accompagnés
par une
fiche de recueil des renseignements épidémiologiques
et cliniques (fiche établie par le CNR des Rickettsia ; d'autres fiches
sont aussi disponibles sur son site http://ifr48.timone.univ-mrs.fr/Fiches/.
Ce
sont les arguments épidémiologiques et cliniques qui permettent
d’engager un traitement, qui ne doit d’ailleurs pas être différé.
Mais le diagnostic ne peut pas être affirmé sans la confirmation
biologique. Les prélèvements adressés au laboratoires
doivent toujours être accompagnés
par une
fiche de recueil des renseignements épidémiologiques
et cliniques (fiche établie par le CNR des Rickettsia ; d'autres fiches
sont aussi disponibles sur son site http://ifr48.timone.univ-mrs.fr/Fiches/.
NB Le traitement antibiotique précoce retarde et atténue l’élévation des anticorps.
L’hémogramme est habituellement normal, laissant quelquefois observer une thrombopénie, une élévation modérée des transaminases est également possible.
Le diagnostic biologique par immunofluorescence indirecte confirme la fièvre boutonneuse pour des titres supérieurs à 1/64 pour les IgM signant une infection récente, ou supérieurs à 1/128 pour les IgG. Le centre national de référence des rickettsioses utilise le Westernblot plus précis et plus spécifique. On peut également pratiquer une PCR.
Le CNR des Rickettsia propose un score
permettant le diagnostic de la fièvre boutonneuse méditerranéenne.
Le diagnostic est vraisemblable lorsque le score dépasse 25.
Le traitement est d’autant plus efficace qu’il est appliqué précocement, il fait appel à la doxycycline per os à raison de 200 mg par jour, pendant 3 semaines, mais des traitements courts, de 3 jours, sont également décrits. En cas d’allergie, la ciprofloxacine peut être utilisée à 1,5g / jour pendant 5 jours chez l’adulte, le chloramphénicol n’est plus utilisé. La josamycine s'est montrée efficace chez la femme enceinte.

Les sulfamides stimulent la croissance des rickettsiales, elles accroissent
notamment la pathogénicité de R. conorii, leur emploi
est contre-indiqué [484].

Les rickettsioses sont inscrites au tableau français des maladies professionnelles
du régime général sous le numéro 53, et
du régime agricole sous le numéro 49.
![]()
![]()
![]()
Quels sont les 3 arguments permettant d’évoquer une fièvre boutonneuse méditerranéenne ?
Dernière mise à jour : le 01 07 2009